Брой 9/2012
Д-р М. Гайдарова
Университетска детска болница
Стандарт за диагностициране на инфекция на пикочните пътища (ИПП) е изолиране на чиста бактериална култура от неконтаминирана проба урина. ИПП може да се групират в три клинично различни групи: цистит, пиелонефрит и асимптомна бактериурия. Циститът представлява инфекция, ограничена на ниво пикочнен мехур и уретра и е най-често срещан при момичета над 2-годишна възраст. Пациентите имат оплаквания от болка при уриниране ( дизурия), често уриниране (полакиурия), инконтиненция на урината, вторичнa дневнa или нощнa енуреза, поява на мътна урина.
Острият пиелонефрит е инфекция на бъбреците и е най-тежката форма на ИПП в детската възраст. Децата обикновено са със системни прояви като фебрилитет, повръщане, коремни болки, втрисане, липса на апетит, раздразнителност. Диагнозата се потвърждава от наличие на маркери на възпалението в кръвта (увеличени С-реактивен протеин и СУЕ ), както и сцинтиграфия с DMSA.
Положителна урокултура може да се установи при деца без симптоми от страна на отделителната система при профилактични изследвания или скрининг. Известни са като асимптомни бактериурии и според някои проучвания (1) се срещат при около 1% от децата в училищна възраст. Антибиотично лечение в тези ситуации не се налага. Рандомизирани клинични проучвания с дългогодишно проследяване показват, че няма разлика в еволюцията на лекуваните и нелекуваните асимптомни бактериурии.
Етиология
В над 80% от случаите ИПП се причиняват от E. coli. Още 10-15% – от други микроорганизми – Klebsiella, Enterobacter, Proteus, Pseudomonas.
Съмнителни за контаминация са липсата на оплаквания от страна на детето, предхождаща манипулация (например поставяне на катетър), липса на левкоцити и отрицателен тест за нитрити в обикновената урина, наличие на повече от 1 вид бактерии в стерилната урина, ниско микробно число.
Инфекции с необичайни микроорганизми (например Pseudomonas) се наблюдават при рецидивиращи инфекции, свързани с приложение на широкоспектърни антибиотици или подлежаща патология (например неврогенен пикочен мехур, обструктивна уропатия) или постоперативно в рамките на вътреболнична инфекция.
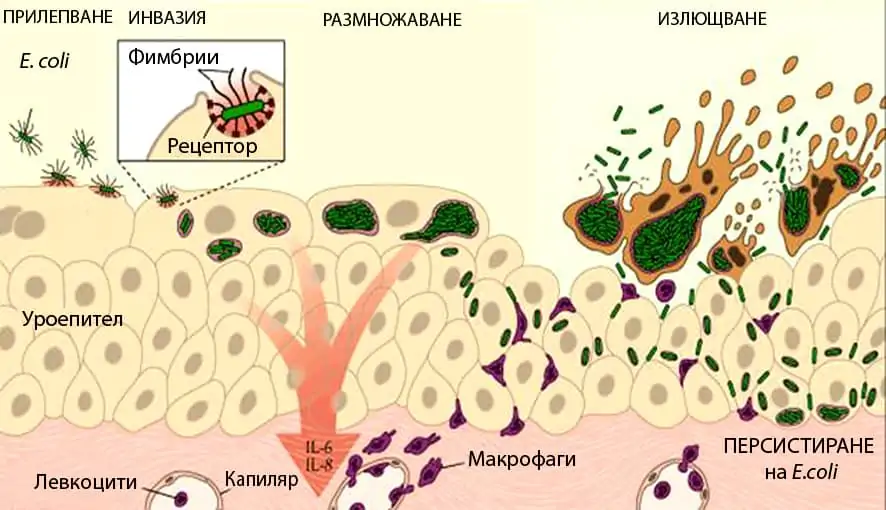
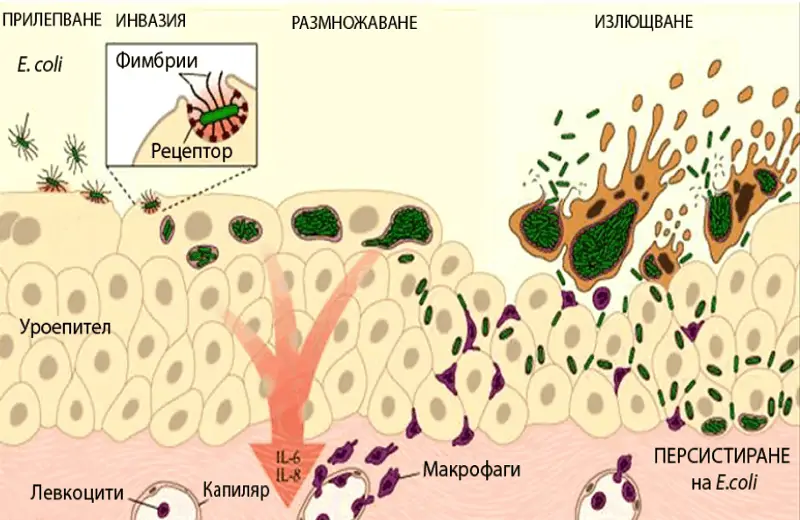
Епидемиология и патогенеза: Момчетата са 5-6 пъти по-склонни към уроинфекции в неонаталния период в сравнение с момичетата. След първата година ИПП се среща по-често при момичетата. Честотата на ИПП е по-висока при необрязани момчета, което се дължи на бактериална колонизация на препуциума. По-високата честота при момичетата е във връзка с по-късата уретра.
Предразполагащи за възникаване и рецидивиране на ИПП са фактори от страна на микроорганизмите и човешкия организъм. Факторите от страна на микроорганизма са техният брой, вирулентност и адхезионна способност.
Факторите от страна на макроорганизма са имунният статус, намалената локална резистентност на пикочните пътища (имуносупресори, недостиг на вит. А, облъчване и др.) и адхезионните места за E. сoli.
Защитните механизми включват синтез на антимикробни глобулини (имуноглобулини), ефикасна бактериална деструкция (лизозим, комплемент) и отговор спрямо антигени (B- и Т-лимфоцити). Тези механизми на имунната система имат своята генетична основа и връзка с фактори на околната среда.
ИПП са често срещани в детската възраст. По литературни данни 8% от момичетата и 2% от момчетата са прекарали поне един епизод на ИПП до 7-годишна възраст. Според едно клинично проучване 5% от децата с фебрилитет на възраст от 0 до 2 месеца имат ИПП.
Методи за колекция на урината
Излючително важно за поставяне на диагнозата и изключване на външно замърсяване е начинът, по който се взема урина. Супрапубичната пункция и трансуретралната катетеризация са методите, при които практически се изключва замърсяване на урината, но поради това, че са много инвазивни, не се използват в практиката. При по-малките деца и бебета основно се използват колектори. При по-големите се използват стерилни контейнери и при възможност се взима средна порция урина.
Диагностични тестове
Във връзка с факта, че отчитането на микробиологичните проби изисква минимум 48 часа, се изследва обикновена урина за нитрити (бърз химичен тест за уроинфекция), левкоцити и бактерии. При наличие на левкоцитоза с олевяване от диференциалното броене на ПКК, ускорена СУЕ, увеличен CRP се счита, че се касае за остър пиелонефрит, а не за остър цистит.
Образни изследвания на отделителната система
Американската академия по педиатрия препоръчва при всяко дете от 2-месечна до 2-годишна възраст да се провежда УЗ изследване на отделителната система и микционна цистография или радионуклидна цистография след прекарана ИПП. Независимо от това авторите не показват данни, които еднозначно да подкрепят необходимостта от провеждането им. Не съществуват препоръки за по-големи деца. Препоръките за Великобритания са за деца под 1-годишна възраст и включват DMSA сцинтиграфия. За тези между 1- и 7- годишна възраст се препоръчва ехография и при наличие на допълнителни критерии – микционна цистография. Доказателства в подкрепа на тези препоръки липсват. Две сравнителни проучвания не показват данни, които да обосноват инвазивните изследвания след ИПП (16).
Ултразвукът показва анатомичните особености на отделителната система, особено ако има дилатация на кухинната система, която може да се наблюдава при обструктивна уропатия. Представлява неинвазивен и лесно достъпен диагностичен метод. Рядко се наблюдават значителни аномалии, поради което прогнозата при по-голяма част от децата не се променя след изследването.
Микционната цистография (МЦГ) се провежда за доказване на наличието или липсата на везикоуретерален рефлукс. Тъй като липсват убедителни доводи в полза на далечната прогноза при деца, диагностицирани и лекувани за ВУР, МЦГ рядко се препоръчва след първа ИПП.
DMSA сцинтиграфия – високосензитивен метод за наличието на бъбречно паренхимно увреждане, както и за процентното участие на всеки един бъбрек в общата бъбречна функция. В стадия на остра инфекция не може да се разграничат обратимите от необратимите изменения. Тежестта на бъбречните паренхимни изменения е важен фактор, определящ далечната прогноза. В литературата има данни, показващи, че наличието на тежки паренхимни изменения на сцинтиграфия при първи епизод на ИПП е фактор, който предразполага към наличие на артериална хипертония в 14 от 15 случая (17).
Сцинтиграфия с MAG-3 и DTPA се провеждат за установяване на наличието на аномалии на отделителната система с обструкция. Това изследване е от втора линия по преценка на детски нефролог.
Лечение
Децата под 1-месечна възраст изискват интравенозно антибиотично лечение, което се провежда в болница (12, 13). Хоспитализират се и деца, при които не е възможно приемането на антибиотик през устата (например с повръщане), както и такива с дехидратация, по-тежко увредено общо състояние и др. Допълнително се уточнява наличието или не на подлежаща аномалия на отделителната система, която да е предпоставка за появата и/или рецидивирането на ИПП. Във връзка с това, че най-често изолираният микроорганизъм е E. Coli, емпирично се започва антибиотично лечение с аминогликозиди и/или β-лактамни антибиотици. Обикновено венозният път на приложение остава до овладяване на фебрилитета, след което се преминава към орално лечение за срок от общо 14 дни.
Схемите на лечение при деца над 1-месечна възраст са различни. При наличие на умерена възпалителна активност се започва монотерапия с антибиотик срещу най-вероятния причинител на ИПП. При данни за значителна възпалителна активност от биохимичните изследвания се започва двойна антибиотична терапия – комбинация от аминогликозиди и цефалоспорини от 3-та генерация. Има клинични проучвания, сравняващи ефекта от интравенозния и оралния начин на приложение на антибиотици при ИПП. Установява се, че няма разлика във времето на овладяване на фебрилитета, наличието на дефекти в бъбречния паренхим на DMSA – сцинтиграфия и честотата на рецидивиране на уроинфекциите при двата начина на приложение на антибактериалните средства (14). Има убедителни данни в подкрепа на факта, че оралният прием е също толкова ефикасен, колкото интравенозният. Независимо от това повечето лекари предпочитат парентералния начин като по-сигурен. Отново продължителността на лечението е 14 дни.
Профилактика на деца с везикоуретерален рефлукс (ВУР)
ВУР дълго време е считан за рисков фактор за рецидивиране на ИПП. Използването на уроантисептична профилактика при деца с ВУР е било стандартна практика за повече от 20 години. Наскоро проведено рандомизирано клинично проучване, сравняващо група пациенти с ВУР – съответно профилактирани и не с антибактериални средства – не показва статистически значима разлика в честотата на ИПП и наличието на паренхимно бъбречно увреждане в двете групи. Други проучвания сравняват оперативната корекция с последваща антибиотична профилактика при деца с ВУР и група на деца с ВУР, оставени само на антибиотична профилактика, и не установяват разлика в риска за бъбречно увреждане в двете групи. В заключение липсват убедителни доказателства в подкрепа на необходимостта от оперативна корекция и/или антибиотична профилактика при деца с ВУР с цел намаляване на увреждането на бъбреците и предимствата са малки, и то основно при намаляване честотата на ИПП.
Червена боровинка (Cranberry)
Има данни, доказващи ефективността на червената боровинка при профилактиката на ИПП. Това се дължи на антиадхезивния, противовъзпалителния и антимикробния й ефект. Проантоцианидините, съдържащи се в червената боровинка, не позволяват на бактериите да се прилепват към лигавицата на пикочните пътища. Хипуровата киселина, която се отделя от кренбери в урината, потиска бактериалния растеж. Салицилатите, които се съдържат в червената боровинка, намаляват възпалението и болката. По литературни данни cranberry значително понижава честотата на рецидивите при уроинфекции. (BMJ 2001; 322: 1571-3). Системно обзорно проучване доказва значително понижаване на уроинфекциите при редовен прием на кренбери (Jepson RG et al: Cranberries for preventing urinary tract infections. The Cochrane Database of Systematic Reviews 2004:CD001321).
Beta Glucan
Аналитичният подход за по-мощна профилактика на ИПП води до необходимостта да се мисли и за повишаване на локалната и общата имунна защита по ефективен и безопасен начин. Проучванията показват, че единственият природен имуностимулатор с доказан механизъм на действие е Beta Glucan. Той представлява несмилаеми полизахариди от клетъчната стена на дрожди, бактерии, лечебни гъби, овес и др. Има способността да се свързва със специфични рецептори на повърхността на макрофагите и други имунни клетки (University of Oxford, 2004). В резултат на това свързване се повишават броят и активността на макрофагите, клетките убийци и др. Увеличава се производството на цитокини (IL1, IL6) и други имуномодулиращи субстанции. Активира се каскадата на клетъчния (Т) и хуморалния (B) имунитет. В резултат се стимулира отделянето на секреторния IgA. Следователно Beta Glucan повишава локалната и общата имунна защита.
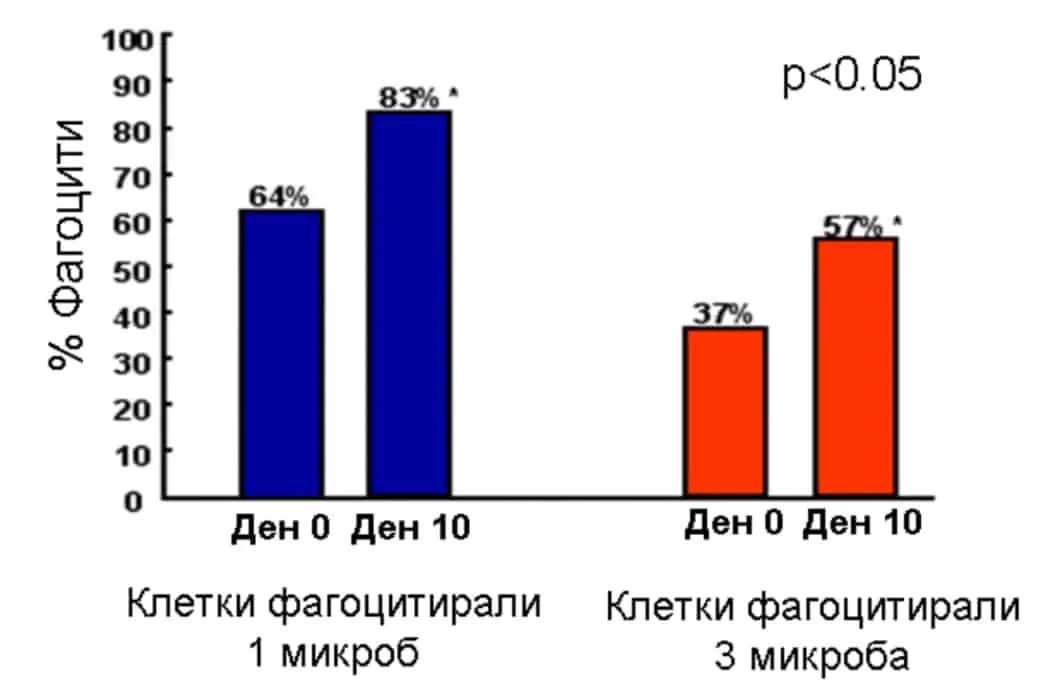
В подкрепа на действието на Beta Glucan се провеждат редица проучвания. Например канадско проучване доказва, че орално приет, Beta Glucan увеличава фагоцитарната активност на макрофагите към E. coli.
Бета глюкан и фагоцитоза на E. coli
Всички тези данни дават основание да се заключи, че в ефективната профилактика на ИПП е уместно да се използват и двете субстанции – Cranberry и Beta Glucan. В момента в България единственият продукт с високи количества и на двете съставки – Cranberry и Beta Glucan, е Imunobor Uro. Моят опит с този продукт ми дава основание да го препоръчам за профилактика на ИПП, асимптомна бактериурия и везикоуретерален рефлукс.
В заключение новите литературни данни, свързани с инфекциите на отделителната система, тяхното лечение, подлежащите аномалии, диагностицирането им, хирургичното им лечение и антибиотичната политика изискват размисъл.
Библиография
1. Kunin CM, Zacha E, Paquin AJ: Urinary tract infections in school
children I. Prevalence of bacteriuria and associated urologic fi ndings,
N Engl J Med 266:1287-96, 1962.
2. Verrier JK, Asscher AW, Verrier Jones ER, Mattholie K, et al: Glomerular
fi ltration rate in schoolgirls with covert bacteriuria, Br Med
J (Clin Res Ed) 285:1307-10, 1982.
3. Cardiff-Oxford Bacteriuria Study Group: Sequelae of covert bacteriuria
in schoolgirls, Lancet 1:889-93, 1978.
4. Wiswell TE, Roscelli JD: Corroborative evidence for the decreased
incidence of urinary tract infections in circumcised male infants,
Pediatrics 78:96-99, 1986.
5. Wiswell TE, Tencer HL, Welch CA, Chamberlain JL: Circumcision
in children beyond the neonatal period, Pediatrics 92:791-3, 1993.
6. Cunningham RJ 3rd: Urinary tract infection in infants and children.
Preventing recurrence and renal damage, Postgrad Med 75:59-64,
1984.
7. Panaretto K, Craig JC, Knight JF, Howman-Giles R, et al: Risk
factors for recurrent urinary tract infection in preschool children,
J Paediatr Child Health 35:454-59, 1999.
8. Winberg J: What hygiene measures are advisable to prevent recurrent
urinary tract infection and what evidence is there to support
this advice? Pediatr Nephrol 8:652, 1994.
9. Blethyn AJ, Jenkins HR, Roberts R, Verrier Jones K: Radiological
evidence of constipation in urinary tract infection, Arch Dis Child
73:534-35, 1995.
10. Lidefelt KJ, Erasmie U, Bollgren I: Residual urine in children with
acute cystitis and in healthy children: assessment by sonography,
J Urol 141:916-17, 1989
11. Travis LB, Brouhard BH: Infections of the urinary tract, Stamford,
CT, 1996, Prentice Hall International.
12. Pantell RH, Newman TB, Bernzweig J, Bergman DA, et al: Management
and outcomes of care of fever in early infancy, JAMA 291:1203-
12, 2004.
13. Hsiao AL, Chen L, Baker D: Incidence and predictors of serious
bacterial infections among 57- to 180-day-old infants, Pediatrics
117:1695-701, 2006.
14. Bloomfi eld P, Hodson EM, Craig JC: Antibiotics for acute pyelonephritis
in children, Cochrane Database Syst Rev (3):CD003772, 2003.
15. Williams GJ, Lee A, Craig JC: Long-term antibiotics for preventing
recurrent urinary tract infection in children, Cochrane Database Syst
Re v (3):CD001534, 2006.
16. Wheeler DM, Vimalachandra D, Hodson EM, Roy LP, et al: Interventions
for primary vesicoureteric refl ux, Cochrane Database Syst
Rev (3):CD001532, 2004.
17. Goonasekera CD, Gordon I, Dillon MJ: 15-year follow-up of refl ux
nephropathy by imaging, Clin Nephrol 50(4):224-31, 1998.