Брой 8/2020
Пациентка на 48-годишна възраст се явява при дерматолог след като личният й лекар е забелязал необичайна кожна лезия на гърдите при преглед за персистираща кашлица и скорошна диспнея. Медицинската й анамнеза е сигнификантна за тревожност и синдром на раздразненото черво с преобладаваща констипация. Липсва неврологичен дефицит, тя има рядко главоболие, а при наличие на такова, то не продължава дълго и обикновено отминава с ибупрофен. Пациентката е непушачка и рядко употребява алкохол. Семейната й анамнеза е сигнификантна отстрана на баща й – с рак на простатата и леля й по майчина линия – с рак на гърдата. Хистологията от направената ексцизионална биопсия открива меланома. Биопсия на сентинелния възел показва, че тя се е разпространила до лимфните възли. Образните изследвания показват няколко метастази в белите дробове и черния дроб. Изследването за мутация открива, че пациентката има генна мутация BRAF V600K. Взето е решение за започване на комбинирана терапия с Инхибитори на имунните контролни точки (ICI) – ипилимумаб и ниволумаб.
Въпрос
Как трябва да се посъветва пациентката, относно наличието на неврологична токсичност?
- Неврологичната токсичност е рядка, но при наличие е често тежка
- Комбинираната терапия с ICI се свързва с по-малък риск от неврологична токсичност, отколкото монотерапията с ICI
- Средното начало на настъпване на неврологичната токсичност е в рамките на месеци от започване на терапия с ICI
- Неврологичните симптоми са чести и трябва да се съобщават на онколог, ако персистират 3 или повече дни
Верен отговор: Средното начало на неврологичната токсичност е в рамките на месеци от започване на терапия с ICI
Ретроспективен преглед разкрива, че средното време до настъпването на неврологични нежелани събития, свързани с имунитета (imAEs), е било 8 седмици след започване на терапия с ICI ; обаче, тези и други imAEs могат да настъпят по всяко време при провеждане на лечението и трябва да се проявява бдителност по отношение на imAEs в рамките на ≥ 1 година след приключването му. Повечето неврологични токсичности са леки, с < 1% от пациентите, при които има събития ≥ степен 3. Въпреки това, пациентите трябва усилено да се насърчават да съобщават за необикновени симптоми на онколог веднага щом ги забележат, независимо колко тривиални тези симптоми могат да им се струват. Пациентите на комбинирана терапия с ICI може да са подложени на повишен риск от по-тежки неврологични imAEs и по-съществена дългосрочна заболеваемост и смъртност, отколкото тези на монотерапия с ICI.
Преглед на неврологичната токсичност и съветите към пациента
Документиран е широк спектър от Неврологичната токсичност след започване на терапия с ICI, включително такива, засягащи периферната нервна система (PNS), като чисто сензорни и смесени сензомоторни полиневропатии, автономна невропатия, Гилен-Баре-подобен синдром, миастения гравис (MG) и миозит и такива, засягащи централната нервна система (CNS), като асептичен менингит и енцефалопатия/енцефалит. Според ретроспективен обзор средното време на настъпване на неврологични imAEs е 8 седмици (обхват 5 дни до 19 седмици) след започване на лечението. Рискът от неврологични imAEs е най-висок при анти-CTLA-4 и анти-PD-1 комбинациите, с общо разпространение 12%, следван от анти-PD-1 антителата самостоятелно (6%) и анти-CTLA-4 антителата самостоятелно (< 4%). При повечето пациенти се изявяват степен 1 или 2 събития, със събития ≥ от степен 3, засягащи < 1% от пациентите при видовете терапии с ICI. Въпреки, че са тежки, неврологичните imAEs като имунно-медииран енцефалит, MG и остра имунна демиелинативна полиневропатия са редки, и те са били свързвани със смърт. Дори леки и умерени неврологични събития могат да доведат до сигнификантна дългосрочна заболеваемост. Следователно, пациентите трябва да се насърчават да съобщават възможно най-рано на онколога си за неврологични симптоми.
Има няколко важни стъпки, които доставчиците на здравни грижи (HCPs) могат да предприемат преди пациента да започне имунотерапия за понижаване риска от imAEs и за гарантиране, че imAEs са открити рано. Това включва поддържане на постоянно, актуално и пълно медицинско досие, извършване на подробна пациентска анамнеза и физикален преглед преди започване на терапия с ICI , както и разяснение на пациентите и техните семейства какво представляват imAEs (Табл. 1). Трябва да бъде дадена възможност на пациентите и техните семейства да се припознаят като основни партньори в грижите за пациента, включително навременното диагностициране на imAEs, и че никога не трябва да се колебаят да комуникират открито с онколог, ако имат въпроси или подозрение, че пациента има imAE. Възможно е някои пациенти да се страхуват да съобщават за imAEs, поради опасение, че ще трябва да спрат лечението, което може да бъде особено свързано при последващите линии на лечение, когато терапиите са вече изчерпани или са лимитирани. Обяснението, че в много случаи те могат да излязат от лечението без резултатите им да бъдат изложени на риск, може да бъде успокояващо.
Табл. 1. Предприемане на важни стъпки преди започване на терапия с ICI за понижение на риска от неврологични и други imAEs
Пациентката започва лечение с ниволумаб 3 mg/kg, последван от ипилимумаб 1 mg/kg в същия ден всеки 3 седмици – 4 дози, след това ниволумаб 240 mg всеки 2 седмици. Тя понася добре първата доза; обаче съобщава за диария 2 дни след втората доза. При диагностичен преглед се открива степен 2 диария, затова се назначава орален метилпреднизолон 1 mg/kg дневно, с който симптомите й отзвучават бързо. Стероидът се понижава бавно и тя получава 3-тата си доза терапия с ICI докато е на ≤ 10 mg преднизон еквивалент дневно. Пет дни по-късно се обажда на онколога, за да съобщи за умерено до тежко главоболие, започнало предния ден следобеда и продължило, независимо от употребата на ибупрофен. Съобщава също, че при събуждане има чувствителност към светлината и скованост във врата. Не съобщава за предишна медицинска анамнеза за главоболие или температура, гадене, повръщане или други симптоми. На следващия ден се явява на преглед при онколога. По време на прегледа жизнените й признаци са стабилни, няма нарушение на менталния статус, но е с некомфортен вид.
Въпрос
Какъв би бил най-подходящия начален диагностичен подход за оценка на симптомите на пациентката?
- Изследване на автоимунни антитела
- Електромиограма (EMG) и изследване на нервната проводимост (NCS)
- Магнитен резонанс (MRI) на мозъка и лумбална пункция
- Степен на седиментация на еритроцитите (ESR)
Верен отговор: Магнитен резонанс (MRI) на мозъка и лумбална пункция
Магнитен резонанс на мозъка (MRI) и лумбална пункция са най-походящите модалности на първи избор за оценка на неврологичните симптоми на пациентката.
Магнитен резонанс на мозъка (MRI) трябва да се направи при всеки пациент с неврологични симптоми като главоболие, фотофобия, замаяност или промяна в ментален статус, докато MRI на гръбначен стълб трябва да се направи на пациенти с мускулни или сензорни проблеми. На пациент с мускулна слабост трябва да се направи MRI на мозъка, MRI на гръбначния стълб, или и двете, в зависимост от местоположението и вида слабост. Лумбалната пункция е важна при пациенти с признаци или симптоми на менингеално раздразнение (главоболие, скованост във врата, фотофобия), за да се изключи лептоменингеална метастаза или инфекциозен менингит. Резултатите от MRI на пациента и лумбалната пункция могат да спомогнат за провеждане на допълнителни диагностични проучвания. Ако тази пациентка е била развила личностни изменения, объркване или загуба на памет, предположението би било менингоенцефалит; в този случай трябва да се прибавят изследване за автоимунни антитела и паранеопластичен панел.
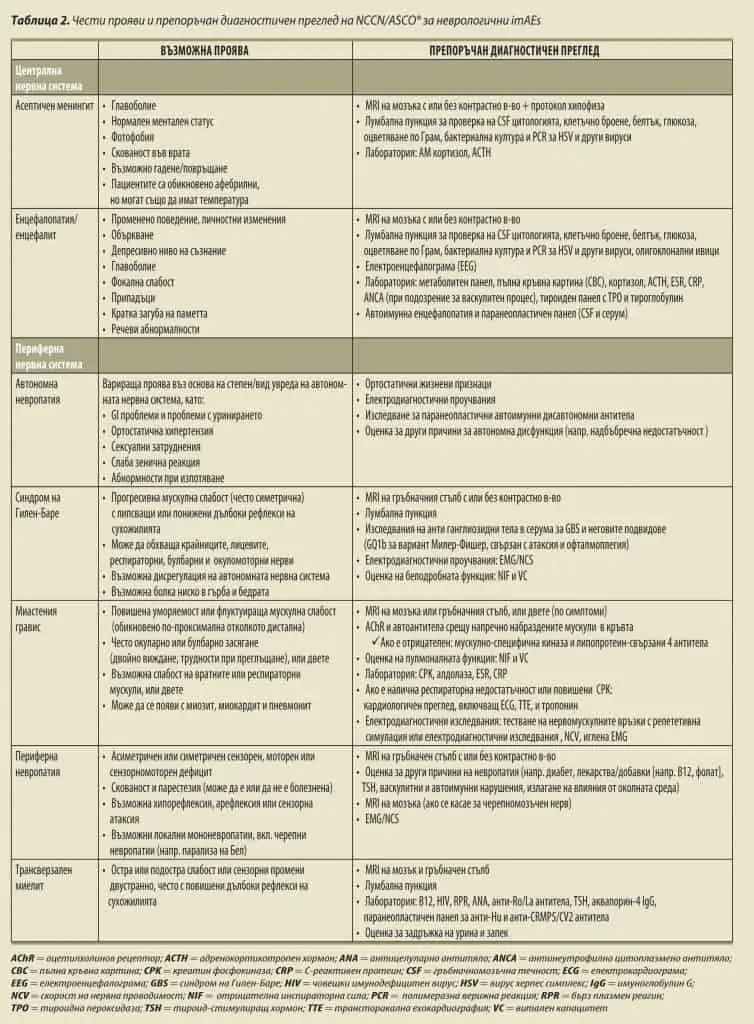
Диагностични проучвания при пациенти с подозирани неврологични imAEs
Неврологичните imAEs могат да бъдат предизвикателна диагноза, тъй като симптомите са неспецифични, проявленията може да са атипитчни, рутинните изследвания – обикновени, може да има припокриване с други imAEs и трябва да се вземат предвид широк спектър от състояния при диференциалната диагноза, включително автоимунни/възпалителни, инфекциозни и злокачествени процеси, както и излагане на фактори от околната среда и лекарства. Следователно, обстойните диагностични прегледи трябва да включват внимателен преглед на медицинската, социална и фамилна диагноза на пациента, физикален преглед, пълен неврологичен преглед с неврологична консултация възможно най-рано, с цел по-добро ръководене на диагностичния преглед. Въпреки че диагностичните проучвания трябва да бъдат приспособени към клиничните прояви на пациента, образната диагностика на мозък и гръбначен стълб могат да са инструментални изследвания при диагностициране на повечето неврологични imAEs, които са диагнози на изключването (Таблица 2). Задължително е да се изключи ново разпространение на рак в CNS. Други полезни диагностични модалности могат да включват електрофизиологично изследване, изследване за автоимунни тела и паранеопластични панели, в зависимост от това кои неврологични imAEs се подозират. Препоръките на NCCN и ASCO® за диагностичен преглед са обобщени в Таблица 2.
Таблица 2. Чести прояви и препоръчан диагностичен преглед на NCCN/ASCO® за неврологични imAEs
Извършеният MRI на мозъка не показва абнормалности. При лумбалната пункция се открива нормално отварящо налягане, бели кръвни клетки (WBC) – 98/µL (нормално, ≤ 5/µL) с преобладаване на лимфоцити, леко повишен белтък – 52 mg/dL и нормални нива на кръвната захар. Предстоят да излязат резултатите от оцветяването по Грам на CSF и култура, изследване за инфекции и цитология. Пациентката съобщава, че наскоро не е пътувала или е била в контакт с някой болен. Направена е предварителна диагноза степен 2 асептичен менингит въз основа на нейната анамнеза, симптоми, MRI на мозъка и настоящите CSF находки. Когато чува думата „менингит“ тя се притеснява изключително и пита дали ще започне да приема антибиотици.
Въпрос
Какво показват настоящите данни, относно ефективноста на използването на антибиотици при пациентите с ICI терапия?
- Без ефект върху преживяемостта без прогресия (PFS) или общата преживяемост (OS)
- Подобрени клинични резултати, независимо от това кога са използвани по време на курса на терапията с ICI
- По-лоша PFS и OS при използване едновременно с терапията с ICI
- По-лоши клинични резултати при кратка употреба преди или рано след започване на терапия с ICI
Верен отговор: По-лоши клинични резултати при кратка употреба преди или рано след започване на терапия с ICI
Все още няма проспективни проучвания, които да са изследвали връзката между употребата на антибиотици и ефикасността на терапията с ICI; обаче, няколко ретроспективни анализа предполагат негативно влияние на антибиотиците върху клиничните резултати когато са приложени за кратко време преди или рано след започване на терапия с ICI. Съществува също доказателство, което предполага че повишената употреба на антибиотици, включително по-дълги периоди на лечение и повече курсове на лечение, могат да имат дори по-голямо негативно влияние върху клиничните резултати.
Асептичен менингит, антибиотици и отговор на ICI
Асептичният менингит се характеризира с менингеално възпаление, често със съпътстваща мононуклеарна плеоцитоза, при отрицателни бактериални култури. MRI може да покаже менингеално усилване. Идиопатичният асептичен менингит се причинява най-често от вируси, но може също да бъде причинен от други патогени (напр. микобактерии, гъбички, спирохети), лекарства (напр. нестероидни и противовъзпалителни лекарства, триметоприм/сулфаметоксазол), заболявания/състояния (напр. системен лупус еритематозус), и злокачествени (напр. лептоменингеална карциноматоза). Табл. 3 очертава критериите за степенуване за асептичен менингит и енцефалит при пациенти на имунотерапия. Въз основа профила на симптомите при тази пациентка и диагностичния преглед, менингитът би се разглеждал като степен 2.
Табл. 3. Критерии за степенуване на асептичен менингит и енцефалит
Тъй като бактериалният менингит е животозастрашаващ и симптомите му могат да бъдат сходни с тези на свързания с ICI асептичен менингит, особено при установяване на токсичност от по-висок клас, насоките на ASCO® предлагат да се обмисли емпирична антибактериална терапия за пациенти със симптоми на менингит докато излязат резултатите им за CSF.
Обаче, ретроспективни данни предполагат, че антибиотиците представляват потенциално обезпокояващ клас лекарства, тъй като се знае, че техните агенти променят чревния микробиом, който е включен в имунотерапевтичните отговори. Необходимо е чрез резултатите от CSF PCR за бактериални антигени или култура да се направи окончателна диагноза, въпреки че пациентите с бактериален менингит често изглеждат по-болни, отколкото че пациентите с техните асептичен менингит. В допълнение към обичайните симптоми на главоболие, фотофобия и скованост във врата, тези пациенти могат да са фебрилни и да демонстрират променен ментален статус. Меланома, която е метастазирала в лептоменингите може също да е със симптоми, подобни на асептичния менингит; следователно, важно е да се оцени цитологията на CSF. Ако няма подозрение за бактериален менингит, антибиотиците могат да бъдат потенциално избегнати при пациенти на имунотерапия. Обаче, силно се препоръчва всеки пациент със симптоми, сочещи бактериален менингит, особено възрастни или имунокомпрометирани пациенти, да преминат на емпирични антибиотици за краткото време до окончателното изключване на диагнозата бактериален менингит.
В здрави черва Bacteroidetes phylum съставляват по-голямата част от микробиома, но при употреба на антибиотици се е наблюдавало понижение на броя им, което от своя страна е било свързано с хронично възпаление и повишен триптофанов катаболизъм. Наблюдавано е, че триптофан-катаболизиращите ензими улесняват имунната евазия чрез ракови клетки. Въпреки че все още не са провеждани проспективни проучвания за изследване влиянието на антибиотиците върху ефикасността на ICI, няколко неотдавнашни ретроспективни проучвания предполагат, че антибиотиците оказват негативно влияние върху клиничните резултати, когато се прилагат за кратко време преди или рано по време на курса на лечение с ICI (Табл. 4). Съществува също доказателство, което навежда на мисълта, че повишената употреба на антибиотици, включително по-дълги периоди на лечение и повече курсове на лечение, може дори да има по-голямо негативно влияние върху клиничните резултати.
Табл. 4. Ретроспективни проучвания, разглеждащи връзката между употребата на антибиотици и ефикасността на ICI
|
Проуч-ване |
Рак |
ICI и ATB |
Синхронизиране на ATB, свързано с началото на ICI и кохорти пациенти |
Заключения и находки |
|---|---|---|---|---|
|
Pinato 2019 |
Недребно-клетъчен белодробен карцином (NSCLC), меланома и други хистологии |
Предимно анти -PD-1/PD-L1 Пеницилини |
ATB ≤ 30 преди ICI с/у ATB едновременно с ICI за ≤ 7 дни NSCLC (n = 119) Меланома (n = 38) Други хистотипове (n = 39) Общо лекувани с ATB преди ICI (n = 28) Общо лекувани едновременно с ATB (n = 68) |
По-лоша OS с ATB преди ICI, но липса на такава с едновременен ATB Предшестващ ATB с/у без ATB NSCLC: OS of 2.5 mo с/у 26 mo (P < .001) Меланома: OS 3.9 mo с/у 14 mo (P < .001) Други хистотипове: OS 1.1 mo с/у 11 mo (P < .001) |
|
Derosa 2018 |
NSCLC и Бъбречно-клетъчен карцином (RCC) |
Анти-PD-1/PD-L1 монотерапия или комбинирана терапия Предимно β-лактам или квинолони |
ATB ≤30 дни от започване на ICI Общо пациенти (N = 360) ATB-treated RCC пациенти (n = 16) ATB-наивни RCC пациенти (n= 105) ATB-лекувани NSCLC пациенти (n = 48) ATB-наивни NSCLC пациенти (n = 191) |
По-лоша OS с ATB с/у без ATB NSCLC: OS of 7.9 mo vs 24.6 mo (HR, 4.4; 95% CI, 2.6-7.7; P < .01) RCC: OS of 17.3 mo vs 30.6 mo (HR, 3.5; 95% CI, 1.1-10.8; P = .03). |
|
Huemer 2018 |
NSCLC |
Анти-PD-1/PD-L1 (ниволумаб или пембролизумаб) Предимно пеницилини, флуороквинолони и карбапенеми |
ATB ≤ 1 от започване на ICI или 1 месец след започване на ICI Общо NSCLC пациенти (N = 30) ATB-лекувани пациенти (n = 11) |
По-лоша OS с ATB с/у без ATB OS 7.5 mo в групата с ATB с/у 15.1 в групата без ATB (HR, 0.31; 95%CI, 0.02-0.78; P = .026) |
|
Tinsley 2018 |
NSCLC, RCC, меланома |
Не са съобщавани ICI Предимно β-лактам и макролиди |
ATB ≤ 2 седмици преди започване на ICI или 6 седмици след започване на ICI Общо пациенти (N = 303) Пациенти с меланома (n = 201) NSCLC (n = 56) RCC (n = 46) ATB-лекувани пациенти сред видовете тумори (N = 94) |
Употребата на ATB е независим предиктор за по-къса PFS и OS Кумулативна употреба на ATB (употреба >10 дни, многократни едновременни или последователни курсове), свързани дори с по-лоша PFS и OS, независимо от клиничните фактори ABT-лекувани с/у ATB-наивни PFS 97 дни с/у 178 дни (P = .049) OS 317 дни с/у 651 дни (P = .001) Кумулативна употреба на ATB PFS 87 дни (95% CI, 83-122; P = .0093) OS 193 дни (95% CI, 96-355; P = .00021) |
ATB = антибиотик; OS = обща преживяемост; PFS = преживяемост без прогресия.
Проучванията за антибиотична употреба при ICI имат много ограничения, включително могат да имат по-голямо влияние върху клиничните резултати, отколкото други. Необходими са проспективни проучвания за по-добро установяване на рисковете, свързани с антибиотиците при лечението с ICI и за определяне начина за подобрение на резултатите на пациенти, при които се изисква употреба на тези агенти; обаче, докато се проведат такива проучвания, доставчиците на здравни грижи трябва да продължат да прилагат най-доброто клинично решение при всеки отделен случай.
Онкологът обяснява на пациентката разликата между асептичен менингит и бактериален менингит и защо тя не трябва да подозира бактериална етиология. Обяснява също, че антибиотиците могат да компрометират отговора на лечението с ICI, което е друга причина тя да предпочете да ги избегне, освен ако те са определено необходими. Пациентката пита как ще бъде лекувана и дали ще е необходимо да бъде хоспитализирана.
Въпрос
Как би се лекувал асептичния менингит при пациентката?
- Продължаване на терапията с ICI и обмисляне на емпирична антивирусна терапия с интравенозен (IV) ацикловир
- Продължаване на терапията с ICI и назначаване на орален преднизон 0.5 до1 mg/kg дневно
- Поддържане на терапия с ICI и назначаване на орален преднизон 0.5 до 1 mg/kg дневно
- Постоянно прекратяване на терапията с ICI и назначаване на висока доза пулс терапия със стероиди
Верен отговор: Поддържане на терапия с ICI и назначаване на орален преднизон 0.5 до 1 mg/kg дневно
Поддържането на имунотерапията и назначаване на нискодозов орален преднизон е подходящ подход за лечение на степен 2 асептичен менингит. Емпиричните антибиотици може да се прилагат до излизане на резултатите от CSF култура, ако се подозира силно бактериалната етиология. Въпреки че с имунотерапия често може да се удължи действието на много нискостепенни не-неврологични imAEs, тя трябва да се приложи дори при наличие на леко до умерени неврологични симптоми докато се извършва диагностичния преглед. Високодозови стероиди (метилпреднизолон 1 до 2 mg/kg d) се препоръчват при умерени до тежки симптоми. Пулсовата терапия (метилпреднизолон 1 g/d за 3 до 5 дни) би била подходяща, ако се подозира едновременно миокардит, енцефалит, или друга животозастрашаваща токсичност.
Лечение на imAEs на CNS: примери – асептичен менингит и менингит
Свързаните с ICI токсичности, засягащи CNS не са толкова чести, колкото тези, засягащи периферната нервна система (PNS). Обзор на клиничните карти и проспективни проучвания е открил, че менингита и енцефалита причиняват съответно приблизително 15% и 19% от неврологичните imAEs, като всяко състояние засяга приблизително 0.1% до 0.2% от всичките пациенти, лекувани с ICI.
Асептичен менингит. Асептичният менингит се проявява обикновено 1 до 7 седмици след започване на ICI. И докато идиопатичният асептичен менингит е често вторичен – след вирусна инфекция, то това не е така в случай на лечение с ICI, тъй като анализите за инфекции при повечето пациенти с това imAE са негативни. Лептоменингеалната метастаза може да се прояви със симптоми, подобни или на менингит, или на енцефалит, така че трябва да се направят MRI на мозъка и цистология на CSF при всяка проява.
Насоките на NCCN и ASCO® препоръчват поддържане на терапия с ICI за всички пациенти с асептичен менингит и болнични грижи за тази с по-тежки симптоми (степен 3/4). Пациентите с лек до умерен асептичен менингит могат да бъдат внимателно мониторирани, без да се хоспитализират и да се лекуват до получаване на резултатите за CSF. Щом се изключи инфекциозна етиология, пациентите с нискостепенен асептичен менингит може да продължат да се проследяват или да се започне лечение с кортикостероиди в доза от 0.5 до 1.0 mg/kg дневно, ако симптомите продължават. За тези със степен 3 или 4 асептичен менингит би трябвало да се предложи интравенозно (IV) метилпреднизолон в доза от 1.0 до 2.0 mg/kg дневно. След като симптомите изчезнат, терапията с ICI може да се поднови за пациенти със степен 1 или 2 асептичен менингит. Препоръчва се прекратяване на терапията с ICI за пациенти с ≥ степен 3 асептичен менингит.
Енцефалит. Енцефалитът е друго потенциално imAE, свързано с ICI. Съобщава се, че той настъпва в рамките на дни до няколко седмици след започване на лечението. Подобно на асептичния менингит, MRI и CSF оценката са важна част от диагностичния преглед за енцефалит и анализите за инфекция могат да са негативни. Диагностичните находки, които могат да насочат към енцефалит, включват повишени WBC с лимфоцитна плеоцитоза, повишен CSF протеин, или и двете. Допълнително, находката на специфичните олигоклонални ивици в CSF може да включва imAE. Образната диагностика на мозъка би трябвало да е нормална или да липсва какъвто и да е процес, който вероятно да е източник на увреждане на менталния статус на пациента като тежък удар, хематом или метастаза в CNS.
Според насоките на NCCN и ASCO® на пациенти с енцефалит може да се предложи проучване с емпиричен IV ацикловир, тъй като HSV енцефалита е диагноза на изключване. Трябва да се проверят вирусните PCRs и ацикловир може да се прекрати, ако PCR е негативен и състоянието на пациента се подобрява с кортикостероиди. Насоките препоръчват също да се поддържа терапията с ICI при пациенти с всякаква степен на енцефалит и да се предложи IV метилпреднизолон 1.0 до 2.0 mg/kg дневно. На пациенти с енцефалит с тежки или прогресиращи симптоми след 24 часа стероидна терапия, или такива, при които се откриват олигоклонални ивици, трябва да се предложи пулсова терапия с кортикостероди с метилпреднизолон 1g IV дневно за 3 до 5 дни плюс интравенозен имуноглобулин (IVIG) 2 g/kg за 5 дни. След консултация с невролог трябва да се обмислят други лечения, включващи ритуксимаб и плазмафераза, за пациенти, при които симптомите са ограничени, или не се подобряват и които са позитивни за автоимунна енцефалопатия или паранеопластични антитела. След отзвучаване на симптомите терапията с ICI може да продължи при пациенти със степен 1 енцефалит. Препоръчва се прекратяване на терапията с ICI за тези с ≥ степен 2 енцефалит.
Заключение
Тъй като терапията с кортикостероиди на пациентката е била предприета когато е развила асептичен менингит, тя е започнала да приема отново преднизон в доза 0.5 mg/kg дневно. На другия ден съобщава, че симптомите й са изчезнали и лечението със стероиди е прекратено след 3 седмици. В същото време резултатите й от оцветяването по Грам, култура и цитология са отново негативни, потвърждавайки диагнозата асептичен менингит. Пациентката започва отново имунотерапия и не развива други imAEs.