Брой 9/2010
Д-р Людмила Владимирова – Китова,
д м, МУ – Пловдив
Хидроксиметилглутарил Коензим А (HMG-Co-A) редуктазни инхибитори, обикновено наричани статини, са инхибитори на холестероловата синтеза. Противно на по-старите химични съединения – като трипаранол и AY-9944, които инхибират крайни стъпала в синтезата (което води до натрупване на междинни стеролови продукти и прояви на токсичност – катаракта, ихтиоза), статините инхибират холестероловата синтеза в ранен етап.
Първото химично съединение, инхибитор на холестероловата синтеза (компактин), беше изолирано от бульон с култура от гъбите Penicillum citrinum и Penicillum brevecompactum, но не беше внедрено за клинична употреба. Структурните му аналози simvastatin и ловастатин, изолирани от Aspergillus terreus, и правастатинът (първо изолиран в урината като метаболит на компактина) бяха лицензирани. Три други синтетични аналога от ранни гъбични метаболити бяха представени на фармацевтичния пазар – флувастатин, аторвастатин и церивастатин (последният беше отхвърлен поради регистрираната повишена поява на миозити).
Тези химични съединения съдържат флуорофенилна група и дихидроксихептанова странична верига, а аторвастатинът – полизаместено пиролово ядро.
Механизъм на действие
Статините са специфични конкурентни инхибитори на ензима HMG-Co-A редуктаза, който катализира скорост-определящата реакция в холестероловия синтез -превръщането на HMG-Co-A редуктазата в мевалонат. In vivo пътят е потиснат приблизително в 40%, като това е определено чрез измерване концентрациите на мевалоната. Количеството на ензима HMG-Co-A редуктаза се повишава, когато се намалява неговата активност, но това не намалява инхибирането на холестероловия синтез в черния дроб.
Като резултат активността на чернодробния LDL-рецептор се увеличава, за да поддържа равновесие с повишеното приемане на LDL-холестерол и намалените плазмени концентрации на LDL-холестерол и Апо-В. Цитоплазменото протеолитично разграждане на мембранно-свързания SREBP се подпомага от намаленото вътреклетъчно холестеролово съдържание. Активният SREBP се транслоцира в ядрото, свързва се с гени – промотори, които увеличават транскрипцията на матрична РНК за LDL-рецептора. Като допълнение при някои пациенти намалява синтезът на LDL-холестерол.
Това, че статините действат главно чрез LDL-рецептор, е потвърдено in vivo чрез lipoprotein turnover studies и ex vivo чрез измерване активността на LDL-рецептор от биопсични проби от черен дроб. Както може да се очаква, статините са по-малко ефективни при пациенти с хомозиготна наследствена хиперхолестеролемия. Въпреки това високи дози simvastatin и аторвастатин водят до по-слабо, но сигнификантно намаляване на LDL-холестерол при тези пациенти. Вероятно поради тази причина като допълнителен ефект освен този върху LDL-рецептор е намаляването на чернодробното излъчване на VLDL и последващата по-слаба продукция на LDL-холестерол.
Синтезът на VLDL е комплекс от процеси, включващи свързването на липиди (триглицериди и холестерол) с Апо-В, който се подобрява от микрозомален трансферен протеин. Инхибирането на HMG-Co-A редуктаза може да повлиява този процес и така да намалява синтеза и излъчването на VLDL. Този ефект допринася и за лекото намаляване на триглицеридите.
Фармакология и клинична ефикасност
Статините се различават по формата на предписване – Lovastatin и simvastatin се дават като лактони, които се хидролизират в черния дроб до отворена киселинна форма.
А правастатин, флувастатин и аторвастатин се дават в отворени киселинни форми.
Структурата на шестте статина е показана на Фигура 1. Отворените киселинни части на молекулите демонстрират учудваща структурна сходност с HMG-Co-A, субстрат за HMG-Co-A редуктазата.
Абсорбцията на статиновите съединения варира. Simvastatin и fluvastatin се абсорбират добре (70-100%), lovastatin и pravastatin – по-малко, съответно 30% и 34%. Степента им на свързване с протеините също варира. Simvastatin, lovastatin и fluvastatin са значително свързани с протеините (>90%), докато pravastatin и неговият основен метаболит се свързват средно между 46 и 57%. Времето на полуживот на статините като цяло е малко (<2 ч.) и основният път на екскреция е през черния дроб. Полуживотът на Atorvastatin е по-голям (>12 ч.)
Atorvastatin, lovastatin и simvastatin се метаболизират чрез цитохром р450 3А3. Флувастатинът се метаболизира чрез р450 2С9, докато правастатинът не се метаболизира чрез системата на цитохромите. Основният продукт на разграждането на pravastatin е 3-хидрокси изомер. В миналото разликите между статините във връзка с лактоновата структура срещу отворената киселинна форма и степента на разтворимост във водна или липидна среда, т. е. хидрофилността срещу хидрофобността, са били предмет на чести дискусии. Поради свободната хидроксилна група правастатин е хидрофилно съединение, докато lovastatin и simvastatinът са хидрофобни заради метилната група на това място. Fluvastatin е относително хидрофилен. Разликите в разтворимостта могат да окажат влияние върху степента, с която различните лекарства се поемат извън чернодробните тъкани (чернодробното поемане изглежда е активен процес), като хидрофобните съединения са способни по-лесно да преминават през всички мембрани, включително и кръвно-мозъчната бариера. Тези различия, които несъмнено съществуват, не се отразяват значимо върху клиническите и биохимическите отнасяния на лекарствата помежду им. Поради активното им приемане от черния дроб, основния first-pass ефект и степента им на свързване с протеини, експозицията на извънчернодробните тъкани към тези съединения е много малка.
Статините са най-мощното средство за намаляване на плазмения LDL- холестерол, като ефектът им варира от 30 до 60%.
Концентрациите на Апо-В изглежда намаляват в степен, сходна с намаляването на LDL-холестерол. Концентрациите на HDL-холестерол се покачват, но само в малка степен (5%). Триглицеридите показват подобно ниско намаление (10-15%).
Статините са проучени сред широк кръг от пациенти.
Първоначалните проучвания на статините са фокусирани върху техните ефекти, върху общия и LDL-холестерол при пациенти с изолирана хиперхолестеролемия. При тях се наблюдава само слаб ефект върху плазмените триглицериди. Неотдавна стана ясно, че статините оказват съществен ефект при пациенти с хипертриглицеридемия. Аторвастатинът беше първият проучен медикамент при пациенти с хипертриглицеридемия. В проучване с доза аторвастатин 5-80 mg/дневно при пациенти с хипертриглициридемия (>3.95 mmol/l) беше наблюдавано намаляване на плазмените триглицериди с 26.5-48.5%.
Впоследствие стана ясно, че всички статини дозозависимо намаляват плазмените триглицериди, ако тяхното основно ниво е над 2.8 mmol/l. При тези анализи намалението на плазмените триглицериди е в подобни пропорции като наблюдаваното намаляване на LDL-холестерол.
Интересен е фактът, че повишението на HDL-холестерол в тази група от пациенти е по-високо. Вероятно статините намаляват плазмените триглицериди чрез повишеното отстраняване на остатъчните частици при метаболизма на богатите на триглицериди липопротеини чрез Апо-В 100/Апо-Е рецептор.
Ефектите върху чернодробната синтеза на VLDL са подобни.
● Установено е, че статините са ефективни при пациенти с дислипидемия тип ІІІ, като е налице значително намаляване на LDL-холестерол и VLDL-холестеролови остатъци. Те са проучени и при пациенти с вторична дислипидемия, включително диабет и нефротичен синдром, където са наблюдавани благоприятни ефекти върху плазмените липиди и липопротеиновия профил.
● При тежки хиперхолестеролемии статините са комбинирани ефективно с анийонно-обменни смоли, като резултатът е бил намаляване на LDL-холестерол приблизително с 50%.
● При тежки смесени дислипидемии статините са комбинирани с фибрати, което е показало добър ефект, но е необходимо внимателно проследяване заради повишения риск от странични ефекти, особено миопатия.
● Известно е, че статините не трябва да се комбинират с Genfibrozil, който чрез все още неизяснен механизъм води до повишаване на техните плазмени концентрации.
● Статините са били проучвани в продължителни, рандомизирани, контролирани клинични проучвания върху влиянието на намаления холестерол върху регресията на атеросклерозата и изходът от тежките коронарни съдови заболявания. Тези проучвания прекратиха предишните спорове относно връзката между цялостната полза на статините и неблагоприятните последствия от употребата им. Различни статини – ловастатин, правастатин и simvastatin – са използвани самостоятелно или в комбинация с други лекарства в много проучвания върху регресията на атеросклерозата. Те показват, че прогресията на коронарните плаки може да бъде забавена, а в някои случаи е отчетена тяхната регресия.
Неблагоприятни ефекти
Като цяло медикаментите се понасят добре и страничните ефекти, водещи до прекратяване на употребата им, са редки. Ясно е, че техният естествен механизъм на действие повишава възможността за странични ефекти, потискайки синтеза на важни биологични съединения -убиквинони и долихоли, които се образуват от мевалонат.
Биохимичните пътища, водещи до убиквиноновото и долихоловото разклонение от фарнезил, предшестват синтеза на сквален. Долихол е необходим за гликопротеиновата синтеза, а убиквинон е важен за митохондриалния електронен транспорт Възможно е инхибирането на HMG-Co-A редуктаза да редуцира отделянето им чрез тези пътища. Но това изглежда не води до значимо намаляване на синтеза им.
Както беше споменато, нивата на мевалонат ин виво намаляват само с 40%, което показва, че вероятно обходните пътища са запазени.
● Друг вторичен проблем би могъл да възникне вследствие действието на статините върху синтеза на хормони. Стероидните хормони се произвеждат от холестерол и е възможно да се мисли, че намалението на холестероловия синтез е свързано с намаление на надбъбречните и полови стероиди. При лечение със статини обаче не е било наблюдавано значимо намаляване на стероидните хормони.
● Страничен ефект, който може да бъде свързан с инхибирането на холестероловия синтез, е намалението на синтеза на жлъчни киселини. Това може да доведе до повишен риск от образуване на жлъчни камъни посредством увреждане на литогенния индекс на жлъчката. При проучвания върху холестероловия баланс е показано, че продукцията на жлъчни киселини е умерено намалена, вероятно вследствие на статиновата терапия. Жлъчният холестерол се намалява в по-висока степен отколкото жлъчните киселини. Отчетено е намаление и на литогенния индекс.
● Най-често срещаните странични ефекти на статините са гастроинтестиналните смущения, които имат тенденцията да се редуцират и изчезват при продължителна терапия. Понякога може да се наблюдава слабост, главоболие и болки. По-ранни проучвания върху експериментални животни, третирани с изключително високи дози статини, показват, че е възможно образуването на катаракта. Това не е наблюдавано при хора и преценяването на очния статус, препоръчвано в по-ранните ръководства, вече не е необходимо.
● Друг нежелан ефект при статиновата терапия е миопатията. За щастие тя е изключително рядко усложнение и се проявява с болезнени и чувствителни мускули, често с грипоподобни симптоми, изключително високо ниво на креатенин-фосфокиназата. В тази връзка всички пациенти трябва да бъдат предупреждавани при поява на тежки мускулни болки да спрат веднага употребата на статини. Миопатията обикновено преминава с прекъсване на лекарството. В редки случаи вследствие на рабдомиолизата може да се наблюдава бъбречна тубулна некроза.
По-голяма вероятност да се прояви миопатия съществува при комбиниране на статини с фибрати. Такъв проблем се наблюдава особено при gemfibrozil.
Повишен риск от миопатия също има при употреба на лекарства, които променят екскрецията на статините и повишават плазмените им нива. Такива са циклоспорин, никотинова киселина, протеазни инхибитори и еритромицин. За да се избегне риск от миопатия, най-добре е приемът на статини да бъде прекратен при тежки интеркурентни заболявания. Те не бива да се приемат и от пациенти с чернодробни нарушения или от алкохолици.
● Общо взето, с изключение на дискутираните случаи, възможностите за взаимодействие между статините и други съединения са ниски. Те вероятно не оказват влияние на системата на цитохром р450. Високото им свързване с протеини трябва да се има предвид при пациенти, които се нуждаят от антикоагуланти. При правастатин обаче не са били наблюдавани промени в антикоагулантното действие на варфарин. Ръководствата за мониториране на биохимичната безопасност на статиновата терапия се промениха с нарастване на клиничния опит. Когато медикаментите бяха въведени, беше препоръчвано често измерване на чернодробната функция. Сега това не е необходимо и чернодробната функция се проверява преди започване на началната терапия и при изследване на липидния профил. Анализите на биохимичната безопасност, натрупани от големи проспективни, рандомизирани и клинични проучвания като 4S, CARE, HPS, показват малка разлика в чернодробните отклонения на двете групи пациенти (приемащи плацебо и приемащи активна субстанция).
Не е рутинна практика да се изследват и нивата на креатенинфосфокиназа. Те варират при здрави индивиди, например след фитнес. Въпреки това при пациенти, които се оплакват от мускулни болки, тяхното определяне е наложително. Малко е известен фактът, че в сравнение с представителите на бялата раса чернокожите имат по-високо ниво на креатенинфосфокиназата.
Дозировка:
– Simvastatin (10-80 mg/дневно);
– правастатин(10-40 mg/дневно);
– флувастатин (10-80 mg/дневно);
– аторвастатин(10-80 mg/дневно);
– ловастатин(10-80 mg/дневно).
Индикации
● Статините са медикаменти на първа линия за лечение на пациенти, при които взетите диетични мерки и промяната в начина на живот не са довели до терапевтичен резултат.
● Те са средства на първи избор при комбинирана хиперлипидемия, при която основното липидно нарушение е повишеният холестерол.
● При тежки хиперхолестеролемии като хетерозиготната фамилна хиперхолестеролемия статините могат да бъдат комбинирани с резини.
● Комбинирането на статини с фибрати е оправдано само при тежки смесени хиперлипидемии и висок риск от коронарен инцидент. Препоръчва се повишено проследяване на безопасността и интензивността на терапията, като най-добре е това да бъде оставено на опитен липидолог. ● Статините не бива да се комбинират с genfibrozil.
● При трансплантирани пациенти, приемащи циклоспорин, е необходимо внимателно мониториране в специализирани центрове. Ако жени във фертилна възраст приемат статини, те трябва да бъдат предупредени да прекратят терапията минимум 6 седмици преди планирано забременяване.
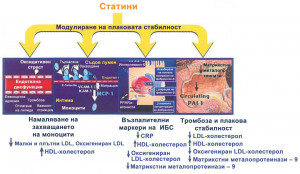
ПЛЕЙОТРОПНИ ЕФЕКТИ НА СТАТИНИТЕ
През последните няколко години нараства интересът към ефекта на статините върху процеси на атерогенезата, независими от холестероловото понижаване. Това са така наречените плейотропни ефекти. Този интерес се стимулира от факта, че по-голямата от очакваната клинична успешност на статините не може да се обясни само с липидорегулиращите им ефекти. Техните плейотропни ефекти в контекста на атерогенезата и превенцията на острите коронарни събития са свързани с:
1. Подобряване на ендотелната дисфункция и кръвоснабдяването на миокарда
● чрез азотния окис (NO), който стимулира образуването на ендотелната NO-синтетаза (eNOS) и стабилизирането й;
●чрез инхибиране синтеза на мощния констриктор ендотелин-1.
2. Антиоксидантни свойства
● намалява чувствителността на LDL-холестерол и HDL-холестерол към окисление;
● потиска способността на макрофагите да окисляват LDL-холестерол.
3. Противовъзпалителни свойства
● намалява нивата на CRP и амилоид А.
4. Инхибира клетъчната пролиферация
● чрез намаление миграцията и пролиферацията на гладко-мускулните клетки, редуциране акумулирането на холестерол в макрофагите, индуциране апоптозата на макрофагите и гладко-мускулните клетки, ограничаване на клетъчното деление по пътя на инхибиране на протеазомите на натрупване на тумор-супресивните р 21 и 27.
5. Антикоагулантни свойства
● намалява нивото на плазминоген-активаторния инхибитор-1 и фибриногена.
6. Стабилизиране на плаката
● инхибира ендоцитозата на естерифициран холестерол;
● намалява броя на макрофагите;
● редуцира ензимната активност на матриксните металопротеинази – 1,2,3,9;
● повишава интерстициалното съдържание на колаген.
7. Инхибира отхвърлянето на сърдечен и бъбречен трансплантат
●потиска митоген-стимулираната пролиферация на В-лимфоцитите.
Плейотропните ефекти се диференцират в бързината на настъпването им във времето.
1. Острофазови – намаляване на тъканния фактор и Тр-активиране.
2. Ранни – намаляване синтеза на азотен окис, вискозитета и агрегацията.
3. Дългодействащи -противовъзпалителен, антиоксидантен, стабилизиращ, понижаващ артериалното налягане ефект.
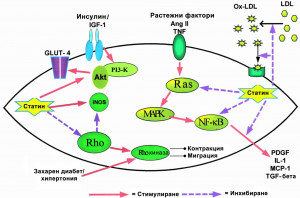
Тези ефекти са свързани с основния ефект на статините, т. е. инхибиране на HMG-CoA редуктаза с намаляване на образуването на мевалонат. Последният е прекурсор на важен изопреноиден, който се свързва директно с мембраната и въздейства върху функцията на интрацелуларните сигнални молекули, в частност малки GTP-протеини Rho, Ras и Rac. Активирането на Rho е свързано с вазоконстрикция, намаляване на азотния окис и активиране на проинфламаторните пътища. Транслирането на Rho към клетъчната мембрана и осъществяване на зависимото посттранслационно модифициране от изопреноид на холестерол биосинтезен път геранилгеранилпирофосфат. Чрез намаляване на продукцията на последния статините намаляват активирането на Rho и предизвикват съответните ефекти. Тези LDL-независими ефекти са осъществяват вследствие на понижаването на LDL-холестерол, като оксигенираният LDL-холестерол активира Rho (Фигура 3).
Фигура 3. Плейотропни ефекти на статините
Eндотелната дисфункция е най-ранната функционална абнормност на съдовата стена, която се представя преди оформянето на атеросклеротични плаки. Нейни основни признаци са абнормност в синтеза, освобождаване и активност на азотния окис (eндотел-зависим релаксиращ фактор). Азотният окис инхибира важни механизми в атерогенезата. Той има потискащ, важен за вазорелаксацията ефект върху съдовата гладкомускулна клетъчна пролиферация, инхибира тромбоцитната агрегация и повлиява левкоцитно/ендотелното взаимодействие. Статините подобряват експресията на еNOS и увеличават образуването на азотен окис. Вазодилататорните възможности на статините се изследват с различни техники ендотел-зависима поток индуцирана вазодилатация, плетизмография, позитрон-емисионна томография – оценя миокардната перфузия. В експериментален модел е установено,че статините имат директен ефект върху стабилизирането на еNOS mRNA. Друго важно тяхно действие е намаляване синтеза на ендотелин-1 и антиоксидантния им ефект. Азотният окис улавя свободните кислородни радикали, а статините намаляват продукцията им. Статините също регулират тъканния плазминоген активатор, down-регулират плазминоген-активаторния инхибитор-1 чрез Rho (Фигура 4).
Фигура 4. Плейотропни ефекти на статините
През последните няколко години беше установено, че при някои случаи статините подобряват ендотел-зависимата вазодилатация, а при други такова подобрение липсва. Тази дисоциация се свързва с високи нива при някои пациенти на инхибитори на еNOS.
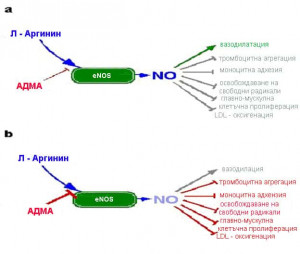
Най-обсъждан в литературата сега е асиметричният диметиларгинин, който има 10 пъти по-голяма плазмена концентрация от другите инхибитори. Отношението Л-аргинин/АДМА контролира активността на eNOS и образуването на NO (Фигура 5 а). При високи нива на АДМА то се променя и това съответно води до блокиране образуването на NO (Фигура 5 б).
Фигура 5. Л-Аргинин/АДМА отношението контролира активността на еNOS:
a – регулация при нормални нива на АДМА;
б – регулация при високо ниво на АДМА.
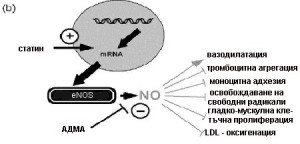
При високи нива на АДМА статините не могат да подобрят генната експресия на еNOS и се стига до резистентност по отношение подобрението на ендотел-зависимата вазодилатация. На сегашния етап се приема, че единственият начин да се преодолее тази резистентност е прибавянето на Л-Аргинин към терапията (Фигура 6–а,б).
Фигура 6. Ефект на нивата на АДМА върху статиновата терапия:
а – резистентност на статините;
б – прибавянето на Л-аргинин променя съотношението Л-аргинин/АДМА и възстановява подобряването на експресията на eNOS.
Съдовата гладкомускулна клетъчна пролиферация и миграция имат централна роля в атерогенезата.
● Статините намаляват гладко-мускулната пролиферация при експериментален модел. Този инхибиращ ефект може да се наруши при добавяне на меволонат. Профилериращият ефект се осъществява чрез активиране на вторичните носители на информация като Ras и Rho. Статините осъществяват своя ефект чрез активиране на тези важни междинни фактори.
● Възпалението е важна компонента на атеросклерозата, моноцити/макрофаги и Т-лимфоцити са основни клетъчни компоненти на атеросклеротичната лезия. Инфламаторните цитокини, продуцирани от тези клетки, влияят върху гладко-мускулната клетъчна пролиферация, ендотелна функция, тромбоза и колагенна деградация. Статините намаляват клетките на възпалението в лезията в различни експериментални модели чрез потискане на клетъчното захващане чрез инхибиране на адхезионните молекули.
● Острофазовият протеин (CRP) се образува в черния дроб в отговор на инфламаторните цитокини като интерлевкин-6. Статините понижават нивото на CRP чрез намаляване на продукцията на интерлевкин-6 от съдовата тъкан.
Голям е интересът към възможните ефекти на статините върху канцерогенезата. ● Lovastatin може да инхибира клетъчната пролиферация чрез инхибиране протозомната деградация на циклично-зависимия киназен инхибитор р21 и р27. Тези молекули имат тумор-супресиращ ефект.
В процес на изследване е ефектът на статините върху стимулиране образуването на костта чрез морфологичен протеин-2 транскрипцията в експериментален модел. Това е нова възможност за терапия на остеопорозата.