Пациент на 51-годишна възраст, бивш пушач, посещава лекарски кабинет със симптоми кашлица и недостиг на въздух. Извършената компютърно томографска (CT) биопсия на бучка на горен ляв лоб показва плоскоклетъчен карцином с пропорция на резултата на лиганд програмираната клетъчна смърт 1 (PD-L1) на тумора под 25%. Обработката разкрива бучка в горен ляв лоб и обемиста медиастинална лимфаденопатия, включваща усложнение от множествени метастази в ипсилатералните медиастинални лимфни възли (multi-station N2). Претърпял е стадиране с позитронно емисионна томография/CT сканиране и магнитен резонанс (MRI) на мозъка, които не са открили някакво допълнително гръдно заболяване. Поставена му е диагноза стадий IIIA на недребноклетъчен белодробен карцином (NSCLC) и е подложен на мултидисциплинарна оценка.
Въпрос 1
Кое лечение е най-подходящо за този пациент?
- Индуктивна химиотерапия, последвана от хирургична намеса
- Химио- и лъчетерапия (CRT), последвана от хирургична намеса
- Едновременна CRT
- Последваща CRT
Верен отговор: Едновременна CRT
Поради наличието на multi-station N2 и обемиста медиастинална лимфаденопатия, този пациент е хирургически неоперабилен. Едновременната CRT демонстрира подобрение на цялостната преживяемост в сравнение с последващата.
NSCLC стадий III
NSCLC стадий III става причина за хетерогенна група заболявания, поради различията в размера на тумора, локация, брой засегнати възли и засегнати лимфни възли. NSCLC стадий III включва 2 отчетливи стадия – стадий IIIA и IIIB, които имат различни прогнози и обикновено се лекуват по различен начин. Около 30% от всички пациенти с новодиагностициран NSCLC са в стадий III. Опциите за стадий III на NSCLC включват хирургична намеса с лобектомия или пневмонектомия в зависимост от стадия на тумора и засягането на лимфните възли. Химиотерапия може да бъде назначена в неоадювантен, едновременен или адювантен период. Лъчетерапия може да се администрира едновременно, последващо или постоперативно. Комбинираните подходи се използват често и поради значителните изисквания на мултимодалната терапия. Решенията за лечение се правят обикновено в мултидисциплинарна среда.
Оптималният терапевтичен подход за пациенти в стадий IIIA на NSCLC остава спорен. За подгрупата пациенти с T3 до T4 N0-1 заболяване и по-висока степен на локация, хирургичната намеса остава осъществима и предпочитана опция. Обаче, продължава полемиката относно оптималното лечение на пациенти в стадий IIIA на заболяването със засягане на голям лимфен възел или засягане на лимфни възли на много места, включително N2. Оценени са тримодалните подходи, използващи предоперативна химиотерапия или предварителна химио- и лъчетерапия, последвани от оперативна намеса.
Роля на хирургичната намеса
INT0139, публикувано през 2009 г., е било най-голямото рандомизирано проучване за оценяване ползата от добавяне на хирургична намеса при пациенти с медиастиноскопски доказан стадий IIIA. Пациентите са били рандомизирани на едновременна химио- и лъчева терапия (CRT) с 2 цикъла на химиотерапия, на платинова основа, последвана или от хирургическа намеса (n=202), или от допълнителна непрекъсната лъчетерапия за достигане до 61 Gy (n=194). Пациентите в двете рамена са получили 2 допълнителни цикъла на химиотерапия с цисплатин и етопозид. Сигнификантно подобрение на преживяемостта без прогресия на заболяването (PFS) е била наблюдавана за три-модалното рамо, (съотношение на риск HR=0.77 [95% CI: 0.62, 0.96], P =.017). Общата преживяемост (OS) не е била подобрена при три-модалното рамо (HR=0.87 [95% CI: 0.70, 1.10], P =.24). Но в анализ на post hoc проучвана подгрупа изследователите съобщават за сигнификантно подобрение на OS при пациенти на CRT, следвана от лобектомия срещу CRT самостоятелно. Пациентите, които са претърпели пневмонектомия обаче не преживяват повече от пациентите, които са само на CRT. В групата с хирургично лечение са настъпили 16 случая на смърт, вкл. 14 пациенти, които са претърпели пневмонектомия. Най-високата предварителна смъртност, наблюдавана при пациенти с пневмонектомия може поне частично да е допринесла за липсата на полза за общата преживяемост срещу CRT самостоятелно. Проведено е подобно фаза 3, рандомизирано проучване с 579 подходящи пациенти в стадий IIIA на заболяването, които са получили 3 цикъла индукционна химиотерапия. След това пациентите са били рандомизирани на окончателна лъчетерапия (n=165), или хирургична намеса (n=154). Не е имало подобрение при добавянето на хирургична намеса, а нивата на средната OS, преживяемостта без заболяване и 5-годишната преживяемост са били сравнявани в двете групи.
Следователно, ролята на хирургичната намеса при пациенти в стадий IIIA на заболяването остава спорна. Неотдавнашно доказателство предполага, че от селектирането на пациенти, чиито тумори са податливи на лобектомия, може да произлиза полза от общата преживяемост от инкорпориране на хирургична намеса в мултимодален подход. Към пациентите, считани за подходящи за хирургическа намеса, трябва винаги да се подхожда мултидисциплинарно – да се преглеждат от екип, включващ хирург, онколог-лъчетерапевт и онколог. Хирургичната намеса може да бъде подходяща за избрани, иначе здрави пациенти, с ограничение на заболяването в медиастимума. Имайки предвид предварителната смъртност и липсата на полза от OS при тримодалната терапия, наблюдавани при INT0139, основният брой пациенти в стадий IIIA на заболяването са лекувани с бимодална терапия с едновременна CRT.
Едновременна CRT
Едновременната CRT е въведена като стандарт на грижи за хирургично неоперабилни или медицински неоперабилни пациенти с локално напреднал NSCLC, обхващащ стадии IIIA и IIIB на заболяването. Проведени са няколко проучвания, които са оценили допълнителната полза от химиотерапия с добавена лъчетерапия последващо или едновременно. Едновременният начин има предимства; химиотерапията може да действа като лъчев сенсибилизатор и да помогне за по-доброто действие на лъчетерапията. В допълнение, тъй като химиотерапията е системно администрирана, тя може да помогне за контролиране на микрометастатичното разпространение на заболяването. В обширен метаанализ от Auperin et al едновременната CRT е демонстрирала подобрение на OS в сравнение с последващата CRT. Този метаанализ е анализирал 6 избираеми проучвания и е включил 1205 пациенти, 92% от които са били случайно избрани. При следното проследяване от 6 години е имало сигнификантна полза от едновременна CRT върху OS (HR=0.84 [95% CI: 0.74, 0.95], P =.004), с абсолютна полза от 5.7% (от 18.1% до 23.8%) на 3 години и 4.5% на 5 години. PFS HR е била 0.90 [95% CI: 0.79, 1.01], P =.07). Едновременното лечение е понижило локорегионалната прогресия (HR=0.77 [95% CI: 0.62, 0.95]; P =.01). Интересно е, че ефектът не е бил различен от този на последващото лечение върху далечната прогресия (HR=1.04 [95% CI: 0.86, 1.25], P =.69).
На пациента е направена мултидисциплинарна оценка, прегледан е от гръден хирург, онколог и онколог-лъчетерапевт. Поради наличието на multi-station N2 и обемиста медиастинална лимфаденопатия, е взето решение да се пристъпи към едновременна CRT.
Въпрос 2
Кой от следните режими на химиотерапия е най-добрият за приложение с едновременно приложение на гръдна лъчетерапия?
- Всеки режим без платина
- Доцетаксел
- Етопозид с платина
- Всеки режим, съдържащ платина
Верен отговор: Всеки режим, съдържащ платина
Оптимален режим на химиотерапия, прилаган с едновременна гръдна лъчетерапия, не е известен; но комбинирани режими на химиотерапията, съдържаща платина са били стандартен подход.
Избор на химиотерапия
Цисплатин и винбластин са били предпочитани лекарства в ранните 1980 години. Оттогава са били проучени няколко агента, служещи за допълваща терапия с платина, вкл. митомицин, етопозид, паклитаксел, доцетаксел, винорелбин, иринотекан и реметрексед. В САЩ са били използвани предимно 2 режима на химиотерапия – цисплатин плюс етопозид и седмично карбоплатин с паклитаксел (Taбл. 1).
Taбл. 1. Списък на проучвания с индуктивна, едновременна и консолидираща химиотерапия при пациенти с неоперабилен локално авансирал NSCLC
Едновременното приложение на цисплатин (50 mg/m2/дневно в дни 1, 8, 29 и 36) плюс етопозид (50 mg/m2 дневно в дни 1 до 5 и 29 до 33) с гръдна лъчетерапия (RT), последвани от 2 цикъла цисплатин плюс етопозид е било оценено в многоцентрово фаза 2 проучване на 50 пациенти с патологично потвърден стадий IIIB на заболяването. Със средно проследяване от 52 месеца, нивата 3 и 5-годишната преживяемост са били съответно 17 и 15%. В рандомизирано фаза 2 проучване, карбоплатин (област под кривата [AUC] = 2) и паклитаксел (45 mg/m2), администрирани седмично чрез лъчетерапия (63 Gy), следвани от 2 цикъла консолидираща терапия (карбоплатин AUC = 6, паклитаксел 200 mg/m2), са дали като резултат средна OS 16.3 месеца.
Тези 2 режима са били сравнявани в рандомизирано проучване на 191 пациенти в стадий III NSCLC, получавали едновременна гръдна лъчетерапия (60 to 66 Gy). На средното проследяване от 73 месеца, пациентите на цисплатин и етопозид са имали подобрено 3-годишно ниво на преживяемост (41.1% vs 26.0%; абсолютна разлика 15% [95% CI: 2, 28]) и тенденция към подобрена OS (23.3 vs 20.7 месеца; HR=0.76 [95% CI: 0.55, 1.05], P =.095).
Голямо проучване на групата Veterans’ Health Affairs е оценило 1842 пациенти, които са били лекувани между 2001-2010 г. Пациентите са били лекувани или с карбоплатин и паклитаксел или с цисплатин и етопозид с едновременна лъчетерапия. Авторите отбелязват, че OS не е била различна между 2-те групи, с HR 0.97 [95% CI: 0.85, 1.10]. Те съобщават, че токсичността е била малко по-висока при етопозид и платина, главно при повишени хоспитализации, инфекции, остра бъбречна недостатъчност и мукозит. Карбоплатин и паклитаксел, прилагани седмично, са били дълго време насърчавани, главно при по-възрастни пациенти със съпътстващи заболявания.
Проучването PROCLAIM е оценило употребата на цисплатин и пеметрексед едновременно с гръдна лъчетерапия, последвани от консолидиращ пеметрексед. Циспластин и етопозид, заедно с лъчетерапия, са послужили като контролно рамо. Пациентите в контролното рамо са получили 2 цикъла консолидираща химиотерапия с дублиране с платина. Цисплатин и пеметрексед са имали общ благоприятен профил на безопасност с общи по-ниски нива от 3-4 нежелани събития. Авторите са направили заключение, че цисплатин и пеметрексед с лъчетерапия, последвани от консолидиращ пеметрексед, са били свързани с приемлив профил на безопасност и могат да се използват като платинов партньор за лъчетерапия за селектирана група пациенти.
Роля на консолидиращата терапия
Администрирането на допълнителна химиотерапия след завършване на пълния курс на цисплатин-базирана химиотерапия и лъчетерапия не е демонстрирало предимство при преживяване. Това проучване фаза 3 на цисплатин и етопозид и едновременна гръдна лъчетерапия с или без консолидиращ доцетаксел е приключило по-рано, поради безполезност след анализ на първоначалните 203 пациенти. Резултатите са показали, че консолидиращият доцетаксел след едновременна CRT е довел до повишена токсичност и не е подобрил OS в сравнение с едновременната CRT самостоятелно. Извършен е бил също мета-анализ на 41 проучвания за ползата от консолидираща терапия след едновременна CRT за стадий III NSCLC. Демографиите са били подобни при проучванията за клиничен стадий, статут при прием, и хистология между групата, получавала консолидация vs групата, неполучавала. Резултатите са показали статистически несигнификантни разлики при OS между групите (19 месеца vs 17.9 месеца; HR=0.94 [95% CI: 0.81, 1.09]; P =.40) и не е наблюдавана разлика в степени 3-5 токсичност. Не е било разумно да се администрират 2 цикъла пълни дози химиотерапия след седмично приложен карбоплатин и паклитаксел, когато са използвани за едновременна CRT за стадий III NSCLC.
Лъчетерапия
Дозата и методът на облъчването са били проучвани екстензивно. Голямо фаза 3 междугрупово проучване RTOG 0617 е включвало 544 пациенти, на които са били администрирани на случаен принцип или стандартна доза RT, с 60 Gy в 30 дневни части, или високодозова RT, с 74 Gy в 37 дневни части. Високодозовата RT е била свързвана с по-кратка преживяемост и повишен риск от летален изход в сравнение с конвенционалната доза RT (средно, 20.3 месеца vs 28.7 месеца; HR=1.38 [95% CI: 1.09, 1.76]; P =.004). Мултивариантен анализ предполага, че ниската преживяемост може да е свързана с по-високите дози облъчване на сърцето.
Това проучване е оценило също употребата на цетуксимаб в комбинация със стандартна CRT. Карбоплатин и паклитаксел е бил химиотерапевтичния режим, използван в комбинация с RT. Нямало е сигнификантно подобрение в PFS или OS с употребата на цетуксимаб.
Пациентът претърпява едновременна CRT с цисплатин и етопозид. Химиотерапията се извършва на дни 1-5, 8, 28-33 и 37. Той получава 60 Gy RT и понася добре режима. Няма оплаквания на сегашната визита. В момента е на етап 3 седмици след приключване на терапията и скенерът не показва признаци на прогресия.
Въпрос 3
Каква е подходящата следваща стъпка за този пациент?
- Обсервация
- Консолидираща химиотерапия
- Консолидиращ дурвалумаб
- Хирургическа намеса
Верен отговор: Консолидиращ дурвалумаб
Въз основа на резултатите от проучването PACIFIC, понастоящем насоките препоръчват консолидираща терапия с дурвалумаб за пациенти, при които няма прогресия на заболяването след едновременна химио и лъчетерапия.
Проучване PACIFIC
PACIFIC е двойно сляпо, плацебо контролирано, фаза 3 проучване за имунотерапия с дурвалумаб след CRT при пациенти в стадий III на локално авансирал, неоперабилен NSCLC. Дурвалумаб е селективен, високо афинитетен имуноглобулин G (IgG)1 моноклонално антитяло, който блокира свързването на PD-L1 към програмираната клетъчна смърт 1 (PD-1) и CD80, позволявайки на T клетките да разпознаят и убият туморните клетки.
Дизайн на проучването
Пациентите са били рандомизирани 1 до 6 седмици след приключване на едновременна CRT на основата на платина. Това включва 2 или повече цикъла на химиотерапия на основата на платина (съдържаща етопозид, винбластин, винорелбин, таксан [паклитаксел или доцетаксел], или пеметрексед) едновременно с дефинитивна RT (54 до 66 Gy). Включените пациенти е трябвало да бъдат >18-годишна възраст, без прогресия на заболяването след CRT и да са били с функционален статус 0 или 1 според Международната здравна организация. Пациентите са обхващали всички хистологии и не са били селектирани въз основа на PD-L1 нивата на експресия. Били са включени общо 709 пациенти; 473 пациенти са претърпели терапия с дурвалумаб 10 mg/kg, администриран всеки 2 седмици за период до 12 месеца, а 236 пациенти са претърпели лечение с плацебо по същата схема. Първичните крайни точки са били PFS и OS. Общото ниво на отговор и продължителността на отговора са били ключови вторични крайни точки.
Характеристика на пациентите
Характеристиките на входно ниво са били балансирани в 2-те групи, вкл. предишна химиотерапия. Средната възраст на всички пациенти е била 64 години и мнозинството са били мъже (70.1%), настоящи и бивши пушачи (91.0%); 45.7% са имали сквамозен хистологичен тип тумор. Мнозинството пациенти в проучването са получили дефинитивна едновременна CRT с дози на облъчване между 54 и 66 Gy.
Ефикасност
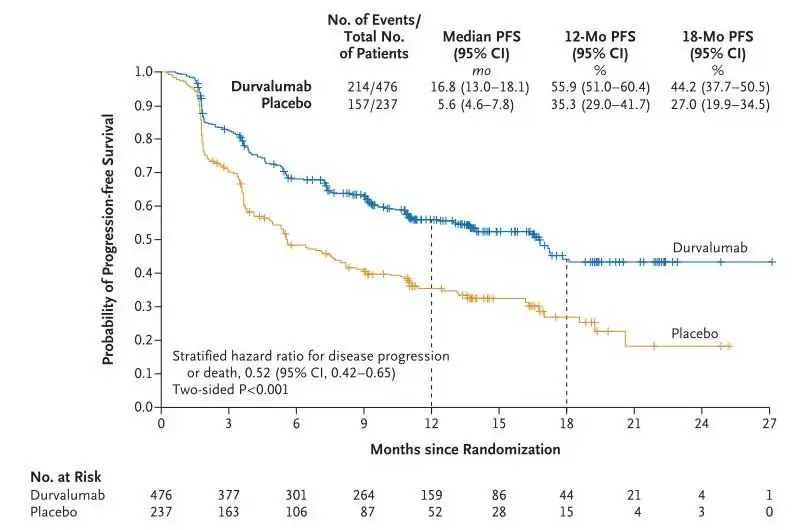
Дурвалумаб е повишил следната PFS (16.8 месеца vs 5.6 месеца; HR за прогресията на заболяването или смъртта 0.52 [95% CI: 0.42, 0.65], P <.001), ниво на отговор (28.4% vs 16.0%; относителен риск (RR) 1.78 [95% CI: 1.27, 2.51]) и средното време до смъртта или далечна метастаза (23.2 месеца vs 14.6 месеца; HR=0.52 [95% CI: 0.39, 0.69], P <.001). Дванадесетмесечното ниво на PFS е било 55.9% (95% CI: 51.0, 60.4) с дурвалумаб и 35.3% (95% CI: 29.0, 41.7) с плацебо, а 18-месечното ниво на PFS е било съответно 44.2% (95% CI: 37.7, 50.5) и 27.0% (95% CI: 19.9, 34.5) (Фиг. 1). Ползата при PFS с дурвалумаб е била наблюдавана независимо от експресията на PD-L1 преди CRT и е била очевидна, и при пушачи, и при непушачи.
Figure 1. PFS from the Intent-to-Treat Population of the PACIFIC Trial
From N Eng J Med., Antonia SJ, et al., Durvalumab after Chemoradiotherapy in Stage III Non–Small-Cell Lung Cancer, 377, 1919-1929. Copyright © 2017 Massachusetts Medical Society. Reprinted with permission from Massachusetts Medical Society.
Безопасност
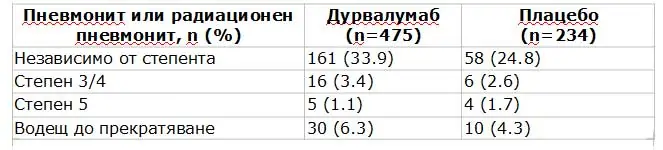
Степен 3 или 4 нежелани събития са настъпили при 29.9% от пациентите, получавали дурвалумаб и 26.1% от тези, получавали плацебо, като най-честото тежко нежелано събитие е било пневмонит. Пневмонит е настъпил при около 34% от пациентите, получаващи имунотерапия vs 25% от получаващите плацебо. Нивата на степен 3 или 4 на пневмонит или радиационен пневмонит са били 3.4% за проучваното рамо в сравнение с 2.6% за плацебо рамото. Нямало е сигнификантни разлики в нивата на степен 5 пневмонит между 2-те рамена (Taбл. 2).
Taбл. 2. Разпространение на пневмонит в проучването PACIFIC
Най-честото нежелано събитие, което може да настъпи след употреба на консолидиран дурвалумаб е пневмонит и пациентите трябва да се мониторират за наличието на симптоми. Клиничното подозрение трябва да се оценява с рентгенографско изображение. Ако се установи рентгенографски наличие на пневмонит, лечението с дурвалумаб трябва да се прекрати. За пневмонит степен 2 или по-висока трябва да се назначат кортикостероиди (преднизон) в доза 1 до 2 mg/kg дневно или еквивалентна за умерен пневмонит (степен 2), или преднизон 1 до 4 mg дневно за по-тежък пневмонит (степени 3 до 4). За пневмонит степен 2 лечението с дурвалумаб трябва да се прекрати докато токсичността достигне степен 1 или по-добра. Лечението с дурвалумаб може да започне отново, ако общата доза кортикостероиди е по-малка или равна на 10 mg еквивалент на преднизон дневно. За пневмонит степен 3 или 4 лечението с дурвалумаб трябва да се прекрати за постоянно.
Изводи от проучването и препоръки за лечение
В заключение, дурвалумаб е демонстрирал статистически значимо и силно подобрение на PFS vs плацебо, нивото на отговор е било подобрено, а при пациентите на дурвалумаб е имало по-ниско разпространение на нови лезии, вкл. нови метастази в мозъка, в сравнение с пациентите на плацебо. Профилът на безопасност на дурвалумаб е бил съвместим с този на други имунотерапии с контролирана токсичност. В проучването не са били идентифицирани нови сигнали на безопасност. Тези резултати показват ефикасността и поносимостта на дурвалумаб за лечение на неоперабилен стадий III NSCLC при пациенти с обективен отговор или стабилно заболяване след завършване на едновременна CRT.
Базирайки се на резултатите от гореспоменатото проучване Насоките на National Comprehensive Cancer Network (NCCN®) препоръчват дурвалумаб като консолидираща терапия (независимо от PD-L1 статуса) за пациенти (функционален статус от 0 до 1) с неоперабилен стадий III NSCLC, който не е прогресирал след 2 или повече цикъла дефинитивна едновременна CRT на базата на платина. Дурвалумаб трябва да се прекрати при пациенти с тежък или животозастрашаващ пневмонит и трябва да бъде отложен или прекратен при други тежки или животозастрашаващи имуно-медиирани нежелани събития (imAEs) както е показано. Това лекарство е одобрено също и от FDA за употреба при това условие за тази особена индикация.
Допълнителни проучвания на консолидираща имунотерапия
Резултатите от проучване фаза 2 на консолидиращ пембролизумаб след едновременна CRT при пациенти с неоперабилен стадий III NSCLC са били представени на Годишната среща на Американското дружество по клинична онкология 2018. В това проучване на 92 избрани пациенти след завършване на едновременна CRT, тези без прогресия на заболяването са получавали пембролизумаб 200 mg IV всеки 3 седмици за период до 1 година. Средната PFS е била 17.0 месеца (95% CI: 11.9, NR). PFS на 12-ти, 18-ти и 24-месец се била съответно 60.2%, 49.9%, и 44.6%. Шестнадесет от 93 пациенти (17.2%) са развили степен 2 или по-висока на пневмонит, 5 (5.4%) са били със степен 3 до 4 пневмонит. Тези ранни резултати предоставят потвърждение за ролята на консолидиращата имунотерапия след завършване на едновременна CRT.
Заключение
От гореспоменатите възможности на избор дурвалумаб е най-подходящият за този пациент, имайки предвид подобренията в PFS, степента на отговор и широката приложимост от резултати, независимо от хистологията и PD-L1 експресията. Както е било демонстрирано в предишни проучвания, не съществува сигнификантно предимство за употребата на консолидираща химиотерапия. Хирургическа намеса не е била предлагана в периода след химио- и лъчетерапия за пациенти като този, които са били с неоперабилна форма на заболяването, тъй като не е имало сигнификантно предимство по отношение на OS или PFS и смъртността при такъв подход може да е по-висока.
Лекарят на този пациент дискутира употребата на предварителна консолидираща имунотерапия като „пакет лечение“, когато се започва за първи път с CRT и се планира продължение с консолидираща имунотерапия за година. “Обикновено изисквам да се направи компютърна томография на гърдите 3-4 седмици след завършване на CRT и ако няма прогресия на заболяването и сигнификантни нежелани събития по това време, процедирам с консолидираща терапия с дурвалумаб. Пациентите се мониторират за нежелани събития и се правят скенери на всеки 3 месеца.”