Брой 7/2019
Д-р Л. Шопов, д-р Б. Кръстев, д-р Р. Илиева, доц. д-р Е. Кинова
Клиника по Кардиология, УМБАЛ „Царица Йоанна – ИСУЛ” – София
Резюме
Инфекциозният ендокардит (ИЕ) е заболяване, свързано с продължителна хоспитализация, високи нива на смъртност и сериозни социално-икономически последствия. В последните десетилетия инфекциозният ендокардит търпи метаморфоза, отразяваща прогреса в здравеопазването. Това е причина заболяването да поддържа висок клиничен интерес.
Въведение
Описан за първи път от Жан Франсоа Фернел[1] и придобил клинична известност след статиите на сър Уилям Ослър[2], инфекциозният ендокардит е все още заболяване с висока смъртност, разпространено навсякъде по света. ИЕ представлява микробна инфекция на нативна или протезна клапа, на ендокардната повърхност на сърцето или на постоянни имплантируеми устройства. Въпреки по-ранното диагностициране със съвременните образни и микробиологични методи и подобрението в медикаментозното и хирургично лечение, нивата на смъртност и тежки усложнения остават непроменени в последните десетилетия. Предизвикателствата, свързани с инфекциозния ендокардит, са по-големи от всякога и се дължат на изменящия се профил на заболяването както отстрана на пациентите, така и отстрана на микробиологичните причинители[3,4].
Епидемиология
ИЕ е рядко заболяване с годишна заболеваемост 3-10 случая на 100000 население[5]. Ревматичната клапна болест персистира като основен рисков фактор в развиващите се страни и представлява около 2/3 от случаите[6], докато в развитите страни е много рядка причина за ИЕ, поради по-високия стандарт на живот и достъпност на антибиотици за лечение на стрептококовите инфекции на горните дихателни пътища[7]. В същото време, състояния като дегенеративна клапна болест, вродени сърдечни болести, захарен диабет, неоплазии, се очертават като основни рискови фактори за инфекциозен ендокардит на нативна клапа[8,9]. Наблюдава се също така увеличение на заболеваемостта при покачване на възрастта на пациентите с пик в седмата декада. Характерно за последните десетилетия са и инфекциите на клапни протези и протезен материал, както и т.нар ИЕ, свързан със здравните грижи (нозокомиален и ненозокомиален). По-честите инвазивни процедури и поставянето на постоянни венозни катетри са причина за повече стафилококови бактериемии. Тази метаморфоза в епидемиологичния профил на заболяването е пряко свързана с напредъка на медицината и застаряването на човешката популация[10,11,12].
Диагноза и класификация
Имайки предвид тези нови тенденции, класификациите от миналото, базирани на тежестта на презентация и скоростта на прогресия на заболяването – остра и подостра/хронична, вече са остарели. Вместо това, инфекциозният ендокардит се класифицира спрямо наличието или отсъствието на интракардиално чуждо тяло, както и според начина на инфектиране. Съответно в първия случай се извеждат следните 4 категории – левостранен инфекциозен ендокардит на нативна клапа, левостранен протезен клапен ендокардит (ранен при <1 година или късен при >1 година от хирургичната интервенция), десностранен ИЕ и ИЕ, свързан с имплантируеми интракардиални устройства. Според начина на инфектиране ИЕ се подразделя съответно на свързан със здравните грижи, т.е. ятрогенен (нозокомиален и ненозокомиален), неятрогенен или придобит в обществото и последно – ИЕ при интравенозни наркозависими[13]. Тези класификации на инфекциозния ендокардит оказват влияние върху това какви диагностични и лечебни мерки ще се предприемат при конкретния пациент.
Още през 1885 г. сър Уилям Ослър отбелязва, че има малко заболявания, за които съществуват толкова трудности при диагностицирането им, както е малигненият ендокардит, и че част от тези трудности са на практика непреодолими[2]. Сто години по-късно диагностицирането на ИЕ често е пропускано или несигурно, водещо до забавяне в лечението и покачване на смъртността и заболеваемостта на пациентите. С навлизането на образните методики в медицината и възможността за идентифициране на микробиологичните причинители се появяват и критерии за диагностициране на ИЕ. Такива са критериите на von Reyn, Duke и използваните най-често към момента модифицирани критерии на Duke, подразделящи пациентите в три групи спрямо наличието на големи и малки критерии – сигурен, възможен и отхвърлен инфекциозен ендокардит[14,15,16]. Въпреки това персистират затрудненията в неговото диагностициране, особено когато се касае за протезен ендокартит или ИЕ, свързан с имплантируеми интракардиални устройства. По тази причина са въведени от Европейското дружество по кардиология (ESC) и допълнителни критерии, базиращи се на образни методики като многосрезова компютърна томография (MSCT), магнитно-резонансна томография (MRI), и нуклеарна образна диагностика (единична фотон-емисионна CT(SPECT/CT) и позитрон-емисионна томография с 18F-флуородеоксиглюкоза (18F-FDG PET/CT)[17].
Независимо от всички новости, основни за диагностиката на инфекциозния ендокардит си остават ехокардиографията и позитивните хемокултури. От десетилетия е известно, че здравият сърдечен ендотел е бариера за повечето микробни причинители и за спонтанната бактериемия при ежедневните активности като хранене и миене на зъбите. След ендотелна увреда, каквато има при дегенеративните и ревматични клапни болести, както и при намаляване на съпротивителните сили на организма, например при захарен диабет и неопластични заболявания, шансовете за развитие на бактериемия и образуване на вегетации се увеличават. Микроорганизмите, които най-често се изолират от хемокултури или тъканни култури се наричат типични причинители на инфекциозен ендокардит. Тук отново има различия в изолатите от последните десетилетия. Като последствие от прогреса в медицината, изразяващи се в по-голяма продължителност на живота, по-чести дегенеративни клапни болести, повече имплантируеми клапи устройства и перманентни централни линии, зачестяват инфекциите с причинители от групата на стафилококите и ентерококите[18,19]. Като в някои проучвания при ендокардит, свързан със здравните грижи, стафилококи се изолират в 55,4% от случаите, а ентерококи, съответно в 22,9%[20].
За сметка на това се отчита намаление в изолирането на оралните стрептококи, които десетилетия наред са основен причинител на инфекциозен ендокардит. Причина за това са по-доброто медицинско обслужване със своевременно антибиотично лечение на стрептококовите фарингити и поддържането на добра устна хигиена[18,19,21]. Дори след промените в препоръките за антибиотична профилактика при инвазивни процедури, изразяващи се в рестрикция на профилактиката само за високорискови дентални процедури при високорискови пациенти, не се регистрира покачване в броя на стрептококовите ендокардити[22,23]. Все по-често, до 31% от случаите при различните източници, кардиолозите се срещат и с ИЕ с негативни хемокултури, представляващи предизвикателство при лечението и поведението при конкретния пациент[24]. Честа причина е антибиотично лечение, което предхожда вземането на хемокултури. Винаги следва да се мисли и за микроорганизми с бавен растеж и трудно култивиране, изискващо специални среди. Такива са Coxiella burnetii, Bartonella spp., Aspergillus spp., Mycoplasma pneumonia, Brucella spp., Legionella pneumophila и гъбички (Candida spp., Aspergillus spp.).
В случаите на ендокардит с негативни хемокултури антибиотичната терапия е емпирична. Ориентация за потенциалните причинители и съответно за провежданата терапия може да дадат познанията ни за локалната епидемиология – причинители и антибиотична резистентност, провежданата до момента антибиотична терапия, както и типа на ИЕ – нативен или протезен, ранен или късен постоперативен.
При дискутиране диагностицирането на инфекциозния ендокардит няма как да не се споменат и клиничните белези на заболяването. До 90% от пациентите съобщават за фебрилитет, често с втрисания в последните седмици. Чести са и общите оплаквания като отпадналост и лесна умора, загуба на апетит и тегло. От обективния статус важни са новодиагностицираните шумове на сърцето. Периферните белези, характерни за т.нар. ендокардитис лента или субакутен инфекциозен ендокардит, израз на съдови емболи или имунологични феномени, се срещат все по-рядко при съвременното протичане на болестта. Те заемат място като малък критерий в диагнозата на инфекциозния ендокардит, заедно с предразполагащите сърдечни заболявания, употребата на интравенозни наркотици, фебрилитет над 38оС и позитивни хемокултури, непокриващи изискванията за голям критерий[17].
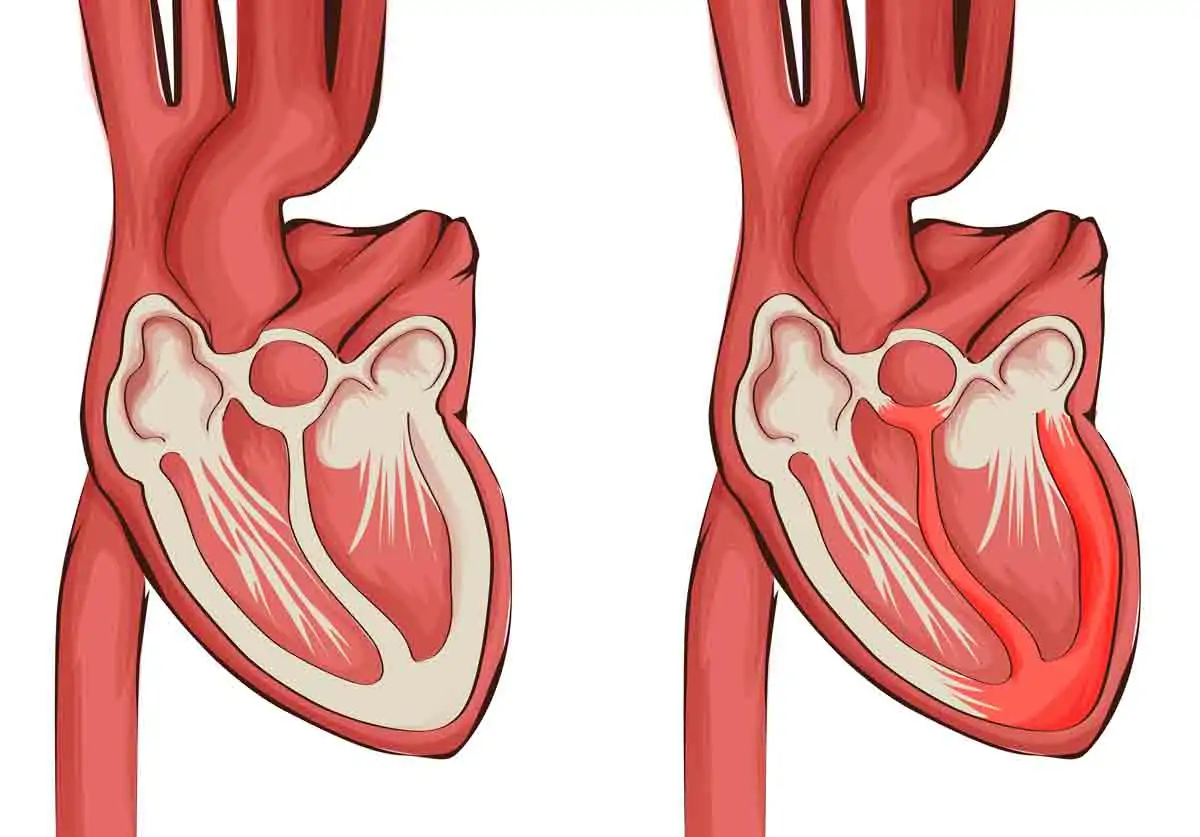
Както беше споменато, ехокардиографията в двете й допълващи се разновидности – трансторакална и трансезофагеална, е основната образна методика за диагностициране на ИЕ, като играе важна роля и в определяне поведението и проследяването на пациентите[25,26]. Ехографските находки са част от големите критерии в модифицираните критерии на Duke, а именно – наличие на вегетация, абсцес, псевдоаневризма, фистула, клапна перфорация, дехисценция на клапна протеза (Фиг. 1). Наличието на допълнителни структури, суспектни за вегетации, е възможно да доведе до фалшиво положителна диагноза ИЕ, тъй като в някои случаи е трудно разграничаването им от тромби, израстъци на Lambl, фиброеластом, марантни вегетации, Libman-Sacks лезии и др. Предвид това следва ехокардиографската картина да се интерпретира в съответствие с клиничната презентация и проследяване.
Терапевтично поведение
Лечението на инфекциозния ендокардит следва да бъде проведено от мултидисциплинарен екип от кардиолози, кардиохирурзи, микробиолози и инфекционисти, съставящи т.нар. ендокардитен тим[17]. Двете направления са антибиотично и хирургично лечение. С диагнозата ИЕ се започва емпирична антибиотична терапия. Основният й принцип е продължителната венозна терапия с повече от един антибиотик, с цел синергично бактерицидно действие и редукция появата на антибиотична резистентност. Важно за клиничния резултат е идентифицирането на патогенния причинител, тъй като в някои случаи на нативен клапен ендокардит може да си спестим втория антибиотик, например при пеницилин-чувствителни орални стрептококи или метицилин-чувствителен S. aureus. В други случаи не само е необходимо едновременното приложение на два антибиотика, но се удължава и продължителността на терапията до 6 седмици, например при изолирани ентерококи. В последните години се използва и т.нар извънболнична парентерална антибиотична терапия, която се състои от две фази[27]. Първата фаза обхваща началните две седмици, които са най-критични и за която е задължителна болничната парентерална терапия. Втората фаза е на продължаващо лечение, което може да се осъществи и в извънболнични условия при липса на усложнения в предходната фаза. Също така все повече започват да се използват и перорални антибиотици в тази фаза[28].
До хирургично лечение се стига в 40-50% от случаите на инфекциозен ендокардит[29,30]. Целта е да се отстранят инфектираните тъкани и да се проведе реконструкция с пластика или протезиране, като биологичните и механичните протези имат сходна оперативна смъртност и изборът между двете е индивидуален. Най-честата индикация е сърдечна недостатъчност, поради клапна регургитация или по-рядко обструкция. Друго показание за операция е неконролируема инфекция, често свързана с разпространение на инфекцията и образуване на абсцес, псевдоаневризма, както и агресивен или резистентен причинител като S. aureus, S. Lugnunensis или гъбички. Третата основна причина за оперативна намеса е предотвратяване на емболизъм. За това е необходима и добра ехокардиографска диагностика, като за рискови се считат вегетациите по-дълги от 10 мм, с добра подвижност и тези на предно митрално платно[31,32]. В последните години се налага концепцията за ранна оперативна намеса, дори още преди да е постигнат контрол върху инфекцията и преди изява на сърдечна недостатъчност[33,34].
Заключение
Инфекциозният ендокардит е комплексно заболяване, което продължава да е с много висока вътреболнична смъртност – до 30% и последваща смъртност след 1 година още до 20% от пациентите. Освен това, персистира трудното диагностициране, особено в условията на скорошна клапна операция и наличие на имплантируемо устройство. Заболеваемостта като цяло също остава непроменена. Независимо от всичко това, заболяването търпи сериозна метаморфоза в последните десетилетия като поразява все по-често пациенти без традиционните рискови фактори. Изменя се и микробиологичният профил с повишаване честотата на представителите на групата на стафилококи и ентерококи. Начинът за справяне с болестта също търпи трансформация със зачестяване на хирургичните намеси и използването на извънболнична парентерална или перорална терапия при неусложнените случаи. Инфекциозният ендокардит ни изправя пред нови препятствия ежедневно, като е важно да вървим в крак с това непрекъснато развиващо се и смъртоносно заболяване.
Библиография
• Grinberg M, et al. Historical aspects of infective endocarditis. Rev Assoc Med Bras. 2011;57(2): 228-33.
• Osler W. The Gulstonian Lectures, on Malignant Endocarditis. Br Med J. 1885; 1(1264): 577-9
• Duval X, Delahaye F, Alla F, et al, and the AEPEI Study Group. Temporal trends in infective endocarditis in the context of prophylaxis guideline modifications: three successive population-based surveys. J Am CollCardiol2012; 59: 1968–76.
• Hoen B, Alla F, Selton-Suty C, et al, and the Association pourl’Etude et la Prévention de l’Endocardite Infectieuse (AEPEI) Study Group. Changing profile of infective endocarditis: results of a 1-yearsurvey in France.JAMA 2002; 288: 75–81
• Murdoch DR, et al. Clinical presentation, etiology, and outcome of infective endocarditis in the 21st century: the International Collaboration on Endocarditis-Prospective Cohort Study. Arch Intern Med 2009; 169: 463–73.
• Cahill T, Prendergast B, Infective endocardatis. Lancet 2016;387: 882-93
• Seckeler MD, et al. The worldwide epidemiology of acute rheumatic fever and rheumatic heart disease. Clin Epidemiol. 2011 Feb 22;3:67-84
• Thomsen RW, et al. Endocarditis and risk of cancer: a Danish nationwide cohort study. Am J Med 2013;126:58–67.
• Hill EE, et al. Infective endocarditis: changing epidemiology and predictors of 6-month mortality: a prospective cohort study. Eur Heart J 2007;28:196–203
• Thuny F, et al. Management of infective endocarditis: challenges and perspectives. Lancet 2012;379:965–975.
• Hoen B, et al, and the Association pourl’Etude et la Prévention de l’Endocardite Infectieuse (AEPEI) Study Group. Changing profile of infective endocarditis: results of a 1-yearsurvey in France.JAMA 2002; 288: 75–81.
• Tleyjeh IM, Abdel-Latif A, Rahbi H, Scott CG, Bailey KR, Steckelberg JM,Wilson WR, Baddour LM. A systematic review of population-based studies ofinfective endocarditis. Chest 2007;132:1025–1035.
• Habib G, et al. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009): theTask Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and the International Society of Chemotherapy (ISC) for Infection and Cancer.EurHeart J 2009;30:2369–2413.
• Von Reyn, et al. Infective endocarditis. Ann Intern Med. 1981;94505- 518
• Durack DT, et al. The Duke Endocarditis Service, New criteria for diagnosis of infective endocarditis. Am J Med. 1994;96200- 209
• Li JS, et al. Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis. Clin Infect Dis 2000;30:633–638
• Habib G, et al. 2015 ESC guidelines for the management of infective endocarditis: the Task Force for the Management of Infective Endocarditis of the European Society of Cardiology(ESC), endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur HeartJ. 2015;36(44):3075-3128.
• Selton-Suty C, et al, and the AEPEI Study Group. Preeminence of Staphylococcus aureus in infective endocarditis: a 1-year population-based survey. Clin Infect Dis 2012;54: 1230–39
• Fowler VG, et al. Staphylococcus aureus Endocarditis:A Consequence of Medical Progress. JAMA. 2005;293(24):3012-3021
• Fernández-Hidalgo N, et al. Contemporary epidemiology and prognosis of health care-associated infective endocarditis. Clin Infect Dis. 2008 Nov 15;47(10):1287-97
• Baddour LM, et al; American Heart Association Committeeon Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young, Council on Clinical Cardiology, Councilon Cardiovascular Surgery and Anesthesia, and Stroke Council. Infective endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications: a scientific statement for healthcare professionals from the American Heart Association. Circulation. 2015;132(15):1435-1486
• Duval X, et al, and the AEPEI Study Group. Temporal trends in infective endocarditis in the context of prophylaxis guideline modifications: three successive population-based surveys. J Am CollCardiol2012; 59(22):1968-76
• Thornhill M, et al. Antibiotic Prophylaxis of Infective Endocarditis. 1968–76. Curr Infect Dis Rep. 2017; 19(2): 9.
• Fournier PE, et al. Comprehensive diagnostic strategy for blood culture-negative endocarditis: a prospective study of 819 new cases. Clin Infect Dis. 2010 Jul 15;51(2):131-40
• Thuny F, et al. Imaging investigations in infective endocarditis: current approach and perspectives. Arch Cardiovasc Dis 2013;106:52–62.
• Habib G, et al. Recommendations for the practice of echocardiography in infective endocarditis.Eur J Echocardiogr2010; 11: 202–19.
• Tice AD, et al. Practice guidelines for outpatient parenteral antimicrobial therapy. IDSA guidelines. Clin Infect Dis 2004;38:1651–1672.
• Iversen K, et al. Partial Oral versus Intravenous Antibiotic Treatment of Endocarditis. N Engl J Med 2019 Jan 31;380(5):415-424.
• Prendergast BD, Tornos P. Surgery for infective endocarditis: who and when? Circulation 2010; 121: 1141–52
• Malhotra A, et al. Infective endocarditis: therapeutic options and indications for surgery.CurrCardiol Rep 2014; 16: 464–69.
• Thuny F, Di Salvo G, Belliard O, et al. Risk of embolism and death in infective endocarditis: prognostic value of echocardiography: a prospective multicenter study. Circulation 2005; 112: 69–75.
• Mügge A, Daniel WG, Frank G, Lichtlen PR. Echocardiography in infective endocarditis: reassessment of prognostic implications of vegetation size determined by the transthoracic and the transesophageal approach. J Am CollCardiol1989; 14: 631–38
• Aksoy O, et al. Early surgery in patients with infective endocarditis: a propensity score analysis. Clin Infect Dis 2007;44:364–372
• Kang DH, et al. Early surgery versus conventional treatment for infective endocarditis. N Engl J Med 2012;366:2466–2473




