Брой 1/2017
Д-р В. Димитрова, доц. д-р Д. Петкова, д.м., д-р В. Стратев, д.м., д-р Т. Добрева, д-р В. Костадинова
Клиника по Белодробни болести, МУ Варна, МБАЛ „Св. Марина“ – Варна
Терминът венозен тромбемболизъм (ВТЕ) включва дълбока венозна тромбоза (ДВТ) и белодробна емболия (БE).Той е на трето място при сърдечно-съдовите заболявания с годишна обща честота на 100-200 на 100 000 жители. ВТЕ може да бъде с неблагоприятна прогноза в острата фаза или да доведе до хронични заболявания или внезапна сърдечна смърт. БE в повечето случаи е следствие на ДВТ. Съществуващите данни за епидемиология, рискови фактори и естествената история на БЕ са получени от изследвания на ВТЕ като цяло.
Клинично значимите нови аспекти на ВТЕ, коментирани в публикуваните през 2014 г. Насоки за лечение на острата БЕ, в сравнение с предишната си версия, издадена през 2008 г., се отнасят до:
1. Наскоро идентифицирани предразполагащи фактори за ВТЕ
2. Опростяване на скалите за определяне на клинична вероятност
3. Роля на D-димера
4. Субсегментна белодробна емболия
5. Инцидентно клинично неподозирана БЕ
6. Стратификация на пациентите с междинен риск за БЕ
7. Започване на лечение с антагонисти на витамин К
8. Лечение и вторична профилактика на ВТЕ с новите орални антикоагуланти (НОАК)
9. Ефикасност и безопасност на лечението на пациенти с междинен риск
10. Ранна дехоспитализация и амбулаторно лечение на пациенти с БЕ
11. Диагностика и лечение на пациенти с посттромбоемболична пулмонална артериална хипертония (СТЕРН).
12. Препоръки за управление на БЕ по време на бременност и на БЕ при пациенти с рак.
Тези нови аспекти са интегрирани в предишните знания, за да се предложат оптимално обективно валидирани стратегии за пациенти със съмнение или при потвърждение за БЕ.
Епидемиологията на БE е трудно да се определи, защото често пациентите могат да останат асимптоматични или диагнозата може да бъде случайно поставена, в някои случаи първото представяне на БE може да бъде внезапна сърдечна смърт. БE е основна причина за смърт, заболеваемост и хоспитализация в Европа. При анализ на 317 000 смъртни случая, свързани с ВТЕ, в шест страни от Европейския съюз (с общо население от 454 400 000) през 2004 г., 34% са се представили с внезапна фатална БE и 59% са били смъртните случаи в резултат от БE. Недиагностицирана БЕ е установена при 7% от пациентите, който са починали. Тъй като пациентите над 40 години са изложени на повишен риск и рискът приблизително се удвоява с всяко следващо десетилетие, все по-голям брой пациенти се очаква да бъдат диагностицирани с БE в бъдеще.
Предразполагащи фактори
ВТЕ се счита, че възниква в присъствието на временен или обратим рисков фактор (като например операция, травма, обездвижване, бременност, перорално прием на контрацептиви или хормонална заместителна терапия) в рамките на последните 6 седмици до 3 месеца преди диагнозата. БE може да възникне и при липса на известен рисков фактор. Наличието на временни рискови фактори може да определи продължителността на антикоагулантна терапия след първия епизод на БE. Голяма травма, хирургична интервенция, фрактура на бедро или на крайниците, ендопротезиране, увреждане на гръбначния мозък са рискови фактори за ВТЕ. Метастатичната болест е добре позната като предразполагащ фактор за ВТЕ. Рискът от ВТЕ е най висок при хематологични злокачествени заболявания, рак на белия дроб, стомашно-чревен рак, рак на панкреаса и рак на мозъка. Бремеността и оралната контрацепция често са предразполагащ фактор за възникване ВТЕ. Когато настъпи по време на бременност, ВТЕ е една от основните причини за майчина смъртност. Рискът е най-висок в третия триместър на бременността, а преди раждането е до 60 пъти по-висок. Ин витро оплождането допълнително увеличава риска от ВТЕ и изисква профилактика с НМХ. Кръвопреливане и средства, стимулиращи еритропоезата, също са свързани с повишен риск от ВТЕ.
Първите изследвания върху естествената история на ВТЕ са извършени в условията на ортопедична операция през 1960 г. Доказателства, събрани след този първоначален доклад, показват, че ДВТ се развива по-рядко при неортопедична операция. Рискът от ВТЕ е най-висок през първите две следоперативни седмици, но остава повишен за два до три месеца. Антитромботична профилактика значително намалява риска от периоперативна ВТЕ. Честотата на ВТЕ намалява с увеличаване продължителността на антитромботична след голяма ортопедична операция и в по-малка степен при операция по повод на рак. Въз основа ретроспективен анализ, кумулативната честота на ВТЕ при пациенти с ранен рецидив на антикоагулантна терапия е в размер на 2,0% в първите 2 седмици, 6,4% след 3 месеца и 8% на 6 месеца. Кумулативният дял на пациенти с късен рецидив на ВТЕ след шест месеца или в случаи след прекратяване на антикоагулация са докладвани при 13% за 1 година, 23% до 5 година и 30% до 10 години. Като цяло, честотата на рецидивите зависи от клиничната картина на първото събитие, ако ВТЕ се повтаря след БE, най-вероятно ще бъде последван отново от БE.
Повишените нива на D-димер по време или след прекъсване на антикоагулацията показват повишен риск от рецидив.
Клинична картина
Клиничната класификация на тежестта на остро настъпил БE се основава на риска от ранна или 30-дневна смъртност. Тази стратификация има значение както за диагностичните и терапевтични стратегии, предложени в тези насоки и се основава на клиничната картина при остър БЕ. Висока степен на риск се предполага при БE в присъствието на трайна артериална хипотония и не много висок риск при липса на такава.
Понякога диагнозата БE може да бъде пропусната, тъй като клиничните признаци и симптоми са неспецифични. При повечето пациенти БE може да бъде обсъждана при симптоми на задух, болка в гърдите, синкоп или кръвохрак. Артериална хипотония и шок са редки, но важни клинични презентации, тъй като те определят наличието на масивна БE. Синкопът е рядък симптом, понякога без наличие на хемодинамична нестабилност. БE може да се презентира безсимптомно или се открива случайно по време на диагноза на друго заболяване или при аутопсия. Болката в гърдите е чест симптом на БE и обикновено се причинява от плеврално дразнене, дължащо се на дистални емболи, които причиняват белодробен инфаркт. При масивна БE болката в гърдите може да има ангинозен характер, вероятно в резултат на ДК исхемия и изисква диференциална диагноза с остър коронарен синдром (ОКС) или аортна дисекация. Задухът може да бъде симптом на масивна или немасивна БE. При пациенти със сърдечна недостатъчност или хронично белодробно заболяване, влошаването на диспнеята може да бъде единствен симптом за БE. Клиничните симптоми и признаци на остра ДК недостатъчност като персистираща артериална хипотония и кардиогенен шок показват висок риск от преждевременна смърт. Освен това, синкопът и тахикардията, както и клинични параметри, свързани с коморбидността, са с неблагоприятна краткосрочна прогноза.
В международния регистър за БЕ (ICOPER) възраст >70 години, систолно АН <90 mm Hg, дихателна честота >20 вдишвания/мин, наличие на злокачествено онкологично заболяване, сърдечна недостатъчност и хронична обструктивна белодробна болест (ХОББ) са идентифицирани като самостоятелни прогностични фактори. Диагнозата на съпътстваща ДВТ също може да бъде независим предиктор за смърт в рамките на първите три месеца след поставяне на диагнозата.
Познаването на рисковите фактори за ВТЕ е важно при определяне на вероятността за БE. Въпреки това, при около 30% от пациентите с БE не могат да бъдат открити провокиращи фактори.
Оценка на клиничната вероятност за БЕ
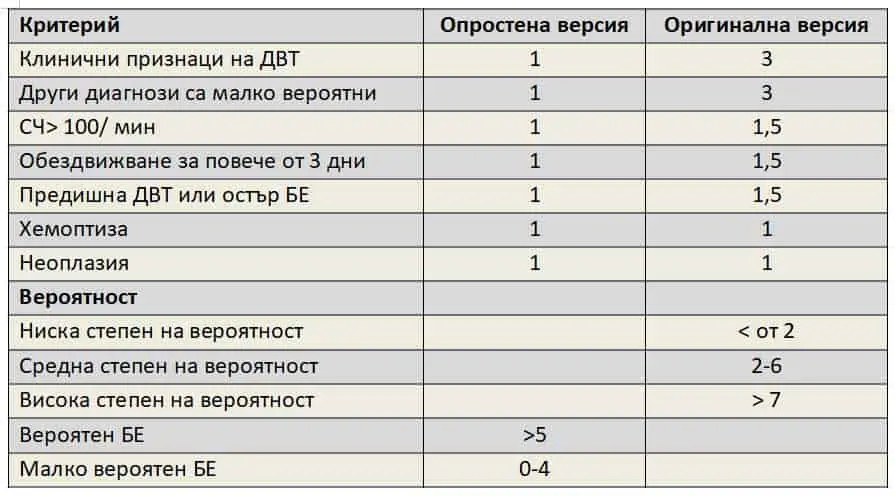
За оценка клиничната вероятност за наличие на БЕ се използват различни скали. Една от тях е скалата на Wells.
Табл.1
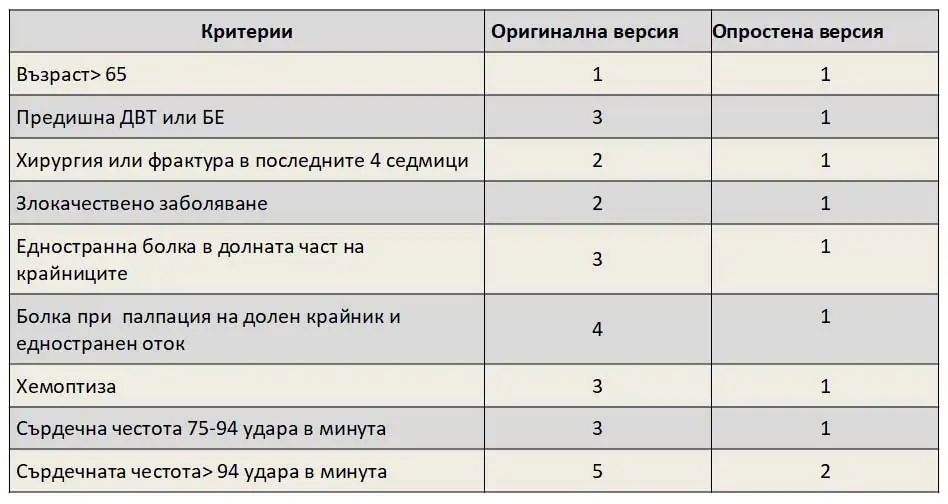
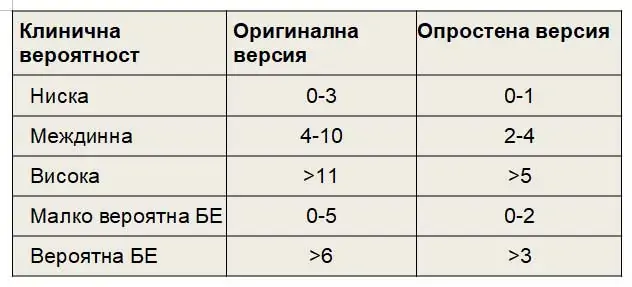
Друга скала за оценка на вероятността от БЕ е Женевската. Резултатът от моделите на точкуване категоризира пациенти в групи с нисък, междинен или висок риск. Наскоро критериите на Женевската скала бяха опростени, в опит да се увеличи приложението им в клиничната практика ( Таблица 2 ).Процентът на пациентите с потвърден БE се очаква да бъде около 10% в категорията ниска вероятност, 30% в категорията на умерено-вероятна и 65% в висока клинична вероятност.
Диагноза
- D-димер: повишен в плазмата в присъствието на остра тромбоза, поради едновременното активиране на коагулация и фибринолиза. Нормално ниво на D-димер прави БE или ДВТ малко вероятни. От друга страна повишени нива могат да се установят при състояния като рак, възпаление, кървене, травма, операция или некроза. Положителната прогностична стойност на повишени нива на D-димера е ниска. Количествените методи имат диагностична чувствителност от 95% и следователно могат да бъдат използвани, за да се изключи остър БE при пациенти с ниска или умерена вероятност. В спешно отделение, отрицателен ELISA тест за D-димер в комбинация с ниска клинична вероятност може да изключи заболяването без по-нататъшно изследване при приблизително 30% от пациентите със съмнение за БE. Спецификата на D-димера при подозиран остър БE намалява постепенно с възрастта до почти 10% при пациенти над 80 години.
- Кръвно газов анализ: хипоксемията се счита за типична находка при остра БE, макар че в 40% от пациентите има нормално насищане на кислорода и при 20% има нормален алвеоларно-артериален кислороден градиент. Хипокапнията също често може да присъства.
- Рентгеново изследване: показва неспецифични промени при остра БE. Препоръчително за изключване на други причини за задух или болка в гърдите.
- ЕКГ: електрокардиографските промени са показателни за ДК обременяване, като инверсия на Т вълни в V1-V4, QR форма в V1, S1Q3T3, непълен или пълен ДББ. Тези електрокардиографски промени обикновено се намират при по-тежките случаи на остър БЕ, при немасивна БЕ може да бъде налице само синусова тахикардия в около 40% от случаите. Предсърдни аритмии, най-често предсърдно мъждене, също могат да бъдат свързани с остър БE.
- Мулти-детекторна компютърна томография (MDCT). След въвеждането й се превръща в метод на избор при съмнение за БE. Тя позволява адекватна визуализация на белодробните артерии до сегментно ниво. Проучване PIOPED II съобщава за чувствителност от 83% и специфичност от 96% за MDCT. PIOPED II също така подчертава влиянието на клиничната вероятност за прогнозната стойност на MDCT. При пациенти с ниска или средна клинична вероятност за остър БE, оценени по скалата на Wells, липсата на дефекти в изпълването на MDCT има висока отрицателна прогностична стойност за БE (96% и 89%). Обратно, положителна прогнозна стойност на MDCT е висока (92-96%) при пациенти с междинна или висока клинична вероятност, но много по-ниска (58%) при пациенти с ниска вероятност за БЕ. Четири клинични проучвания предоставят доказателства в полза на MDCT като самостоятелно изображение за изключване на PЕ. Взети заедно, тези данни показват, че отрицателната MDCT е подходящ критерий за изключване БE при пациенти с ниска клинична вероятност. MDCT, която потвърждава остър БE на проксимално ниво, е достатъчно доказателство за БE при пациенти с ниска клинична вероятност. При пациенти с изолирана субсегментна БE и липса на дълбока венозна тромбоза решението за това дали да се лекува пациента трябва да се обсъжда за всеки отделен случай, като се вземат предвид клиничната вероятност и риска от кървене. Диагностичната стойност и клиничното значение на MDCT при субсегментни дефекти все още се разискват. Случайно откриване на клинично неподозирана БE при MDCT е все по-често срещан проблем възникнал в 1-2% от всички направени изследвания, най-често при пациенти с рак, с пристъпно предсърдно мъждене или сърдечна недостатъчност.
- Вентилационно-перфузионната сцинтиграфия (V/Q ) е диагностичен тест, който може да бъде използван при съмнение за остър БE. V/Q сцинтиграфия може преференциално да се прилага при амбулаторни пациенти с ниска клинична вероятност и нормална рентгенография на гръдна клетка, при млади (особено жени) пациенти, по време на бременност, при пациенти с анамнеза за алергия към контрастно вещество, при бъбречна недостатъчност и при пациенти с миелом и парапротеинемия. Резултатите от V/Q сцинтиграфия на белия дроб често се класифицират в съответствие с критериите, установени в проучването PIOPED: нормално или близко до нормалното сканиране, висока степен на вероятност и при ниска и средна вероятност се счита, че изследването е недиагностично за БE. Високата честота на недиагностични изследвания с междинна вероятност е било причина за критики към този вид изследване, поради необходимостта от по-нататъшно диагностично тестване.
- Белодробна ангиография: от десетилетия остава „златен стандарт“ за диагноза или изключването на БE, но рядко се извършва, поради това че по-малко инвазивната MDCT ангиография има подобна диагностична стойност. Белодробната ангиография по-често се използва за перкутанно катетър насочено лечение при остър PE. В проучване на 1111 пациенти смъртността, свързана с процедурата е 0.5%, големи нефатални усложнения настъпват при 1% и незначителни усложнения при 5%. По-голямата част от смъртните случаи се наблюдават при пациенти с хемодинамична нестабилност или дихателна недостатъчност.
- Ехокардиография (ЕХОКГ): БE може да доведе до ДК обременяване и дисфункция, която може да бъде потвърдена чрез ехокардиография. Критериите за поставяне на диагноза БE са различни в различните клинични проучвания. В около 40-50% от пациентите не се откриват характерни белези за остро ДК обременяване, отрицателният резултат обаче не може да се изключи БE. От друга страна признаци на ДК обременяване или дисфункция могат да бъдат намерени в отсъствието на остра БE и могат да се дължат на сърдечно или респираторно заболяване. Показателите за тежка ДК дисфункция са: ДК хипокинезия , белег на McConnell (акинезия в среден сегмент с нормокинезия на апикалния сегмент на свободната ДК стена), кинетика на междукамерната преграда, както при тензионно обременяване на ДК и систолно налягане в ДК СНДК >40 mm Hg. Измерването на ТАPSE (tricuspid annulus plane systolic excursion) също може да бъде полезно. Нови ехокардиографски параметри на ДК дисфункция, получени от доплерово изследване, са докладвани при наличие на остра БE, но те са неспецифични и могат да бъдат нормални при хемодинамично стабилни пациенти, въпреки наличието на остър БE. Ехокардиографията не се препоръчва като задължително изследване при диагноза при хемодинамично стабилни, нормотензивни пациенти със съмнение за БE (при нисък риск на вероятност). При пациенти с висок риск липсата на ехокардиографски белези на ДК обременяване или дисфункция на практика изключва БE като причина за хемодинамична нестабилност. Ехокардиографията може да бъде от полза при диференциалната диагноза на причината за шок чрез откриване на перикардна тампонада, остра клапна дисфункция, тежка ЛК дисфункция, аортна дисекация или хиповолемия. Обратно, при хемодинамично компрометирани пациенти със съмнение за остър БE недвусмислени признаци като повишено налягане в артерия пулмоналис и ДК дисфункция оправдават спешна реперфузия, ако незабавно MDCT ангиография не може да бъде осъществена.
- Компресионна венозна ултрасонграфия (CUS): В повечето случаи острият БE е свързан с ДВТ на долните крайници. В проучване с помощта компресионна венозна ултрасонграфия (CUS), ДВТ е установена при 70% от пациентите с доказана БE. CUS до голяма степен заменя венографията за диагностициране на ДВТ. CUS има чувствителност >90% и специфичност от 95% при симптоматична ДВТ. Наличието на проксимална ДВТ при пациенти с подозрение за остър БE се счита за достатъчно основание за започване на антикоагулантна терапия без по-нататъшно изследване.
Диагностични стратегии
Честотата на потвърдена остра БE при пациенти, подложени на диагноза, поради съмнение за заболяване, е доста ниска (10-35%) в големи серии. Използването на диагностични алгоритми е оправдано, скалите за оценка на клиничната вероятност, измерване нивата на D-димер и образните изследвания, които са предложени са валидирани. Тези стратегии са изследвани при пациенти със съмнение за БE в спешното отделение и по време на престой в лечебно заведение. Неспазването на диагностичните стратегии, основани на доказателства, когато има наличие на рисков фактор, е свързано със значително увеличение броя на епизодите на ВТЕ и внезапна сърдечна смърт при тримесечно проследяване.
Лечение
При пациенти с остър БE антикоагулация се препоръчва с цел предотвратяване на ранна смърт и рецидивираща симптоматична или фатална ВТЕ. Стандартната продължителност на антикоагулация трябва да продължи най-малко 3 месеца. В рамките на този период лечението в острата фаза включва парентерална антикоагулация с нефракциониран хепарин или нискомолекулярен хепарин (НМХ) през първите 5-10 дни. Парентералното приложение на хепарин трябва да се припокрие със стартиране на лечението с индиректен антикоагулант или може да се последва от прилагане на един от новите орални антикоагуланти: dabigatran или edoxaban. За rivaroxaban или apixaban пероралното лечение трябва да се стартира след 1-2 дни приложение на нефракциониран хепарин или НМХ. В последния случай лечението след острата фаза се състои от повишена доза на перорален антикоагулант през първите 3 седмици (за rivaroxaban 2х15мг., след което 20 мг дневно) или 7 дни (за apixaban първоначално 2х10мг, последвани от 5мг. дневно).
В някои случаи продължителна антикоагулация след първите 3 месеца или за неопределено време може да е необходима за вторична профилактика след претегляне на риска от рецидив при всеки отделен пациент срещу риск от кървене.
Резултатите от клиничните проучвания, използващи НОАК при лечение на ВТЕ, показват, че тези средства са не по-малко ефикасни и безопасни (особено от гледна точка на масивно кървене), отколкото при използване на стандартната схема за лечение: нефракциониран хепарин/индиректен антикоагулант. В момента НОАК могат да се разглеждат като алтернатива на стандартното лечение. В момента на публикуването на тези насоки rivaroxaban, dabigatran и apixaban са одобрени за лечение на ВТЕ в страните на Европейския съюз, edoxaban е в процес на регулаторен преглед. Опитът с НОАК все още е ограничен, но продължава да се натрупва. НМХ се препоръчват за амбулаторно лечение при пациенти с рак и ДВТ най малко 3-6 месеца.
Няма никакви надеждни данни, които да ръководят решението за това, как да се управлява неподозирана БE с антикоагуланти, но повечето експерти са съгласни, че пациенти с рак и с дефекти в лобарни или на проксимално ниво клонове трябва да се лекуват с антикоагуланти.
Пациенти с БЕ, които се представят с шок или хипотония са изложени на висок риск от смърт в болница, особено през първите няколко часа след инцидента. Системна тромболиза е лечение на избор при пациенти с висок риск. При пациенти с противопоказания за тромболиза и при тези, при които тя не е била успешна и не е възстановила хемодинамиката, се препоръчва хирургическа емболектомия.
Тромболитичното лечение на острия БE възстановява белодробна перфузия по-бързо от антикоагулация само с нефракциониран хепарин. В началото води до бързо намаляване на налягането в белодробната артерия, с едновременно подобрение в ДК функция. Разликите обаче вече не са видими в двете групи пациенти една седмица след лечението при анализ на ехокардиографските показатели.
Пациентите с един епизод на остър БE и персистиращи оплаквания от задух и белодробна хипертония е вероятно да страдат от хронична пост тромбоемболична пулмонална хипертония. След прецизна оценка пациенти със СТЕРН се насочват към експертен център по белодробна хипертония за хирургично лечение – белодробна ендартеректомия (PEA).
Оценката на риска от рецидив при пациенти с непровокирана БE е сложен. Някои рискови фактори могат да помогнат за идентифициране на пациенти с по-висок дългосрочен относителен риск от рецидив един или повече предишни епизоди на ВТЕ, антифосфолипиден синдром, наследствена тромбофилия или остатъчна тромбоза в проксималните вени. Допълнителен рисков фактор за рецидив е запазването на ДК дисфункция при ехокардиографско проследяване на 6-я месец след първия инцидент. От друга страна нивото на D-димера един месец след спиране на индиректния антикоагулант изглежда да е предиктивен фактор за повторна поява на ВТЕ (RR 0.4). Носителите на тромбофилия, пациенти с потвърден дефицит на протеин С или протеин S, пациенти с хомозиготен дефект на фактор V Leiden или хомозиготна мутация G20210A (PTG20210A), са кандидати за антикоагулантно лечение за неопределен период от време след първото събитие на ВТЕ .