Брой 1/2017
Доц. д-р В. Юрукова, д.м., д-р Д. Димитрова
Клиничен Център по Белодробни болести, СБАЛББ ”Света София” ЕАД
Медицински Университет – София
Резюме
Бронхиалната астма (БА) е често и потенциално сериозно заболяване, което може да бъде контролирано, но не лекувано.
Симптомите на заболяването са свирене в гърдите, недостиг на въздух, бодежи в гърдите, кашлица, които варират във времето, честотата и интензивността.
Лечението на БА е непрекъснат цикъл на оценка, корекция и проверка. Базира се на две основни направления за контрол на заболяването: симптомите през последните 4 седмици и рисковите фактори за възникване на неблагоприятни последствия.
Желателно е терапията да започне най-рано с контролиращо лечение след поставяне на диагнозата БА. Прилага се стъпаловиден подход.
Всички пациенти трябва да имат писмен индивидуален план за действие по отношение на заболяването.
Комбиниране на самонаблюдение и редовни медицински прегледи води до понижаване на смъртността и заболеваемост от БА.
Бронхиалната астма (БА) е хетерогенно заболяване, което се характеризира с хронично възпаление на дихателните пътища. Определя се като история за респираторни симптоми – свирене, недостиг на дишане, стягане в гърдите и кашлица, които варират във времето, честотата и интензивност, заедно с променливо ограничение на ексипираторния поток (1).
Познати са кластери на демографски, клинични и/или патофизиологични характеристики, които често се наричат «фенотипи астма». Някои от най-честите фенотипи на БА са (2, 3, 4):
1. Алергична астма: ранна поява още в детството, фамилна история за алергично заболяване като екзема, алергичен ринит или алергия към храни или медикаменти. Изследването на индуцирана храчка преди лечение често показва еозинофилно възпаление в дихателните пътища. Тези пациенти отговарят добре на терапия с инхалаторни кортикостероиди (ИКС)(5).
2. Неалергична астма: при някои възрастни астмата не е свързана с алергия. Клетъчният профил на спутума може да бъде неутрофилен, еозинофилен или да съдържа малко възпалителни клетки (паусигранулоцитен тип). Тези пациенти отговарят по-малко на ИКС(6, 7).
3. Астма с късно начало: наблюдава се по-често при жени с начало на заболяването по-късно при възрастни. Те са неалергични, често изискват високи дози кортикостероиди или са релативно рефрактерни на кортикостероидно лечение (8).
4.Астма с фиксирана лимитация на въздушния дебит: някои пациенти при продължителна история на заболяването развиват фиксирана лимитация на въздушния дебит, което се дължи на ремоделирането на стената на дихателните пътища (9,10,11).
5. Астма при физическо усилие – лека интермитентна, с активация на мастоцити, Th2 цитокини и цистенил левкотриени.
6. Астма със затлъстяване: някои пациенти със затлъстяване, предимно жени, липсват Th2 биомаркери.
Честота
БА засяга 10-15% от децата и 5-10% от възрастни. Най-висока честота (до 36.8%) на заболяването е установена в англо-говорящите страни: Обединеното кралсто, Нова Зеландия, Австралия, Република Ирландия, след което някои центрове в Америка. Най-ниска честота (1.6%) се наблюдава в Индонезия, Гърция, Китай, Тайван, Узбекистан, Индия и Етиопия (1).
Честотата на БА е най-висока в детска възраст като пикът е при деца на 5 г. възраст, а втория пик е при подрастващите. При деца до 15 г. астмата е по-честа при момчетата, а след 15 г. възраст се наблюдава повече при жени.
Честотатата на БА в България е средно около 9% (12).
Рискови фактории за БА
I. Ендогенни фактори:
- генетична предизпозиция
- атопията
- бронхиална хиперреактивност
- пол
- раса/етнос
II. Екзогенни фактори:
1.Фактори, които повлияват възприемчивостта за развитие на БА в предразположени индивиди:
- Домашни алергени
- Външни алергени
- Професионални сенсибилизатори
- Тютюнев дим
- Замърсяване на въздуха
- Респираторни инфекции
- Паразитни инфекции
- Социоикономически статус
- Размер на фамилията
- Диета и медикаменти
- Затлъстяване
2. Фактори, които причиняват екзацербацията на БА и/или са причина да персистират симптомите
- Домашни и външни алергени
- Домашни и външни замърсители на въздуха
- Респираторни инфекции
- Усилие и хипервентилация
- Промени на времето
- Серен двуокис
- Храни, добавки, медикаменти
- Екстремна емоционалност
- Тютюнев дим (1)
Клинична патология на БА
Поставянето на диагнозата изисква да се определят едновременно характеристиките на респираторните симптоми и на вариабилната лимитация на въздушния дебит (1):
1. История за вариабилни респираторни симптоми – свирене, недостиг на въдух, стягане в гърдите и кашлица:
- Повече от един симптом (свирене, недостиг на въздух, кашлица, стягане в гърдите)
- Влошаване на симптомите през нощта или рано сутрин
- Симптомите варират по време и интензивност
- Сиптомите са тригери от вирусни инфекции, простуда, усилие, експозиция на алерген, промяна във времето, смях или иританти като замърсен въздух, пушек или силни миризми
2. Потвърдена вариабилна лимитация на експираторния въздушен дебит чрез:
- Документирана прекомерна вариация на белодробната функция
- Документирана лимитация на въздушния дебит
- Положителен бронходилататорен реверзибилен тест
- Прекомерна вариация на двукратно измерения за денонощието Върхов Експираторен Дебит (ВЕД) в продължение на 2 седмици
- Сигнификантно подобрение на белодробната функция след 4 седмично противовъзпалително лечение
- Положителен тест при натоварване
- Положителен бронхопровокационен тест
- Прекомерна вариация на белодробната функция между визитите
Хистопатология
Първите промени са инфилтрация на субмукозата с мононуклеарни клетки -макрофаги, CD4+T лимфоцити, еозинофили и неутрофили. Освен възпалението се наблюдава персистираща вариабилност на структурните промени в дихателните пътища, което се означава с термина ремоделиране. Ремоделирането включва задебеляване на базалната мембрана, хипертрофия и хиперплазия на гладката мускулатура, нарастване броя на мукусните Гоплетови клетки, депозиция на екстрацелуларен матрикс (колаген, фибронектин и тензацин) под епителната базална мембрана и в субмукозата, наличие на неоваскуларизация в резултат на пролиферация на васкуларното капилярно легло (12, 13).
Персисиращото възпаление в дихателните пътища заедно с ремоделирането са отговорни за бронхиалната хиперреактивност към специфични и неспецифични стимули.
Процесът ремоделиране определя нарастване на съпротивлението на дихателните пътища и способстват за влошаване на белодробната функция при хронична астма.
Класификация на БА
Класификация по тежест (1)
Интермитентна астма: честота на пристъпите <1 път седмично (болният е асимптомен и с нормален ВЕД между отделните пристъпи); симптоми на нощна астма ≤ 2 пъти месечно; ВЕД е ≥ 80% от предвидената за пациента стойност с дневни колебания <20%. Персистираща лека астма: пристъпи ≥ 1 път седмично, но не ежедневни; симптоми на нощна астма ≥ 2 пъти месечно; ВЕД ≥ 80% от предвидения, но с вариабилност 20-30%. Персистираща средно тежка: пристъпите са всеки ден, което нарушава физическата и социална активност на болния. Ежедневна употреба на β2 -агонисти; нощните пристъпи са повече от 1 път седмично; ВЕД е 60-80% от предвидената стойност с вариабилнос <30%.
Персистираща тежка астма: пристъпите са постоянни, физическата активност е силно ограничена; нощните симптоми са чести; ВЕД е ≤ 60-80% от предвидената стойност и вариабилност <30% въпреки оптималното лечение.
След започването на лечението се определя нивото на контрол и БА може да бъде:
- Контролирана БА: без дневни и нощни симптоми, нормална физическа активност, без нужда от БДБА, нормална вентилаторна функция и без обостряния на състоянието през последната година.
- Частично контролирана БА: поява на някои от симптомите или понижение на вентилаторните показатели, обостряне.
- Неконтролирана БА: при наличие на три или повече симптома/понижение на вентилаторни показатели, ежеседмични обостряния.
Клиника
Клиничната картина на БА включва 4 основни симптома: задух, стягане в гърдите, свирене в гърдите и кашлица. Проявяват се като дневни епизоди, нарушаващи обичайната активност на пациентите или нощни пристъпи от задух, нарушаващи съня и почивката. Най-характерна проява на БА е асматичният пристъп. Той може да настъпи по всяко време на денонощието, но най-често през нощта. Болният се събужда с тежест в гърдите, заема ортопноично положение, има мъчителна, дразнеща кашлица, хриптене (2).
Физикално: видимо дишането е затруднено и учестено, с придружаваща тахикардия. С перкусия може да се установят хиперсонорен перкуторен тон, нисък стоеж на диафрагмата, ограничена или липсваща респираторна подвижност. Аускултация – отслабено или изострено везикуларно дишане, удължен експириум, сухи свиркащи и хъркащи хрипове. Облекчение носи инхалирането на бързодействащ симпатомиметик.
При тежък астматичен пристъп, продължаващ от часове до денонощия, се говори за астматичен статус. Той не се повлиява достатъчно от бронходилататорно лечение. Чести причини са рязко прекъсване на лечението, маси вен контакт с алерген, вирусна инфекция и неправилно лекуван астматичен пристъп. Клинично се характеризира със: тежка диспнея при покой, говор с отделни думи и къси изречения, цианоза, тахипнея над 30/мин., тахикардия над 120/мин., ВЕД под 40-50% от предвидения или под 100 Литра в мин., хипоксемия рО2 под 60mm, парадоксален пулс при спадане на систолично налягане с повече от 25 mm Hg при инспириум (нормално е до 10 mm Hg). Аускултаторно в началото се установяват дифузно сухи свиркащи хрипове, които може драматично да изчезнат при т.наречения “тих бял дроб” , промени в психо-неврологичното състояние – от тревожност и смъртен страх до прекома и кома (2).
Диагноза
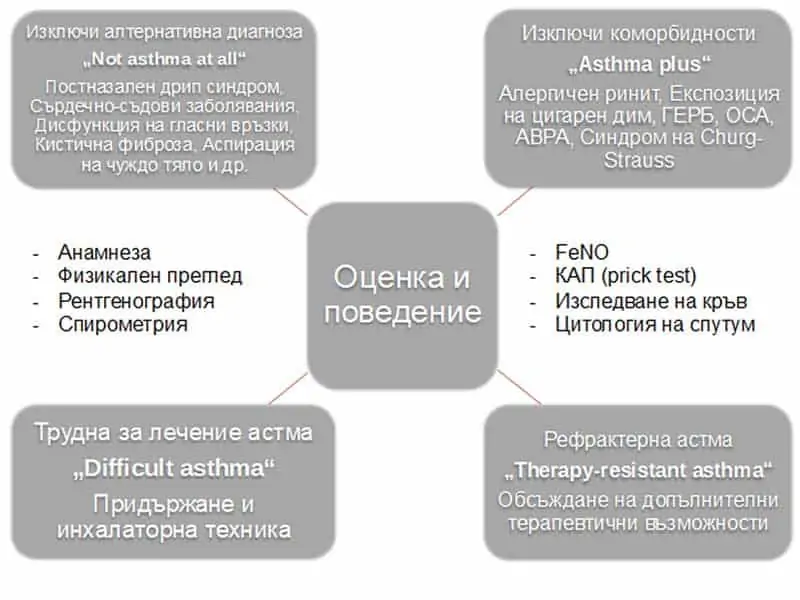
За поставяне на диагнозата предлагаме следния алгоритъм:
Фиг.1 Диагностичен алгоритъм при БА
Лечение
Постигане на добър контрол на симптомите, поддържане на нормални нива на активност, намаляване на бъдещия риск от екзацербации, фиксираното ограничение на въздушния поток и нежеланите лекарствени събития са дългосрочните цели при лечение на БА.
Постигането на тези цели изисква партньорство между пациентите и медицинските специалисти.
Глобална Стратегия за ръководене и превенция на астмата GINA представя лечението на астмата като един непрекъснат цикъл на оценка, корекция и проверка (1).
Лечението се базира на две основни направления за контрол на заболяването: симптомите през последните 4 седмици и рисковите фактори за възникване на неблагоприятни последствия.
Оценката се извършва чрез използването на валидирани въпросници и тестове за контрол на астмата, като Астма контрол тест (ACT) и Въпростник за контрол на астмата (ACQ)(1).
Дългосрочно проследяване на ВЕД се препоръчва при пациенти с тежка астма и при нарушено възстановяване на бронхиалната обструкция.
Леката форма на бронхиална астма се характеризира с осигурен добър контрол на стъпка 1 и 2 от лечението (при нужда бързодействащ бета 2 агонист (БДБА) или ниска доза ИКС).
За умерено тежка форма се счита добре контролирана астма на стъпка 3 от лечението (ниска доза ИКС/дългодействащ бета 2 агонист (ДДБА).
Тежката астма изисква лечение на стъпка 4 или 5 (висока доза ИКС/ДДБА), за да се осигури контрол, или въпреки това лечение остава неконтролирана.
При лечението се прилага стъпаловиден подход (Фиг.2):
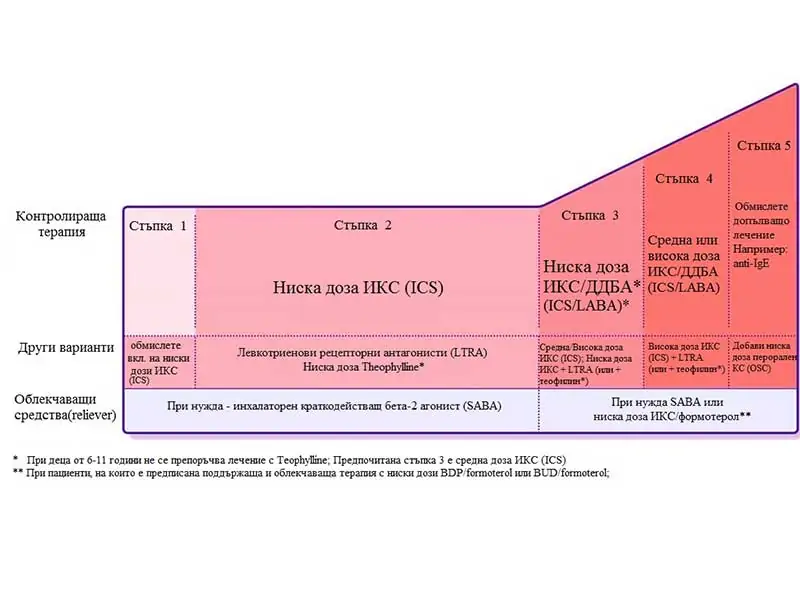
Стъпка 1 –БДБА за облекчаване на астматичните симптоми. Този вариант се прилага при пациенти с нечести симптоми (по-малко от два пъти месечно), с кратка продължителност и без никакви рискови фактори за екзацербация. При пациенти с риск от екзацербация се добавя редовен прием на ниска доза инхалаторен кортикостероид (ИКС).
Стъпка 2 – Прилага се редовен прием на ниска доза (ИКС) и при нужда инхалаторен БДБА. Други възможности са левкотриенови рецепторни антагонисти (ЛТРА) и при нужда БДБА, комбинация от ниска доза ИКС/дългодействащ бета2-агонист (ДДБА) и при нужда БДБА. При чисто сезонна алергична астма без симптоми в интервалите се препоръчва интермитентен прием на ИКС и при нужда БДБА.
Стъпка 3 –Ниска доза ИКС/ДДБА и при нужда БДБА или комбинация ниска доза ИКС/formoterol като поддържаща доза и терапия при нужда. Други възможности са да се повиши дозата на ИКС или да се добави левктриенов антагонист или се добави theophylline.
При деца 6-11г.: предпочитана терапията е ИКС в средна доза и при нужда БДБА. Друга възможност е (при деца на 6-11 г.) да се добави ДДБА.
Стъпка 4 – Възрастни или юноши: поддържаща терапия с комбинация с ниска доза ИКС/Formoterol като поддържаща терапия и терапия при симптоми или комбинация от средна доза ИКС/ДДБА и при нужда БДБА. Други възможности са: Добавяне на Tiotropium с инхалатор респимат (финна мъгла) при пациенти на възраст ≥12 год. и история за екзацербации, високи дози комбинация от ИКС/ДДБА с малка полза, но нарастване на риска за странични явления, нарастване на честотата на дозите при инхалаторите съдържащи budesonide, или добавяне на левтротриенови антагонисти или ниски дози theophylline.
При деца (6-11 г.) с лош контрол при лечение със средни дози ИКС е необходимо експертно мнение и оценка.
Стъпка 5 – насочване към специализиран център за изследване и лечение от специалист. При неконтролирани симптоми или персистират екзацербациитее необходима проверка на инхалаторната техника и придържане на лечението. При пациенти на възраст ≥12 год. и история за екзацербации, добавяне на Tiotropium чрез инхалатор респимат, при тежка алергична астма добавяне на omalizumab (anti-IgE), при тежка еозинофилна астма добавяне на mepolizumab (anti-IL5) ( при лица ≥12 год.)(1, 15).
Лечение, определено по изследване на храчките: добавяне на ниска доза перорални кортикостероиди (≤7.5 mg дневно преднизон или еквиваленти)(16-19). При някои пациенти може да доведе до повлияване на симптомите, но има значителни системни нежелани ефекти. Задължително се препоръчва мониториринг за остеопороза.
При тежка астма задължително трябва да се потвърди диагнозата, да се провери за алтернативни диагнози или фактори, допринасящи за симптоми като дисфункция на горните дихателните пътища, ХОББ, повтарящи се инфекции на дихателните пътища, оценка на съпътстващи заболявания като хроничен синузит, затлъстяване, ГЕРБ, обструктивна сънна апнея, психологически или психиатрични нарушения, проверка на техниката на инхалиране и правилния прием на лекарството и проверка на персистираща експозиция в околната среда (2, 15).
Нефармакологични стратегии: бронхиалната термопластика, насърчаване за отказване от тютюнопушене, откриване на алергени и тяхното елиминиране от околната среда, избягване на медикаменти провокиращи обостряне на астмата, изчерпателна програма за насърчаване на правилния прием, физическа активност с протекция на бързо действащ бронходилататор, диета, отслабване, справяне със стреса (1).
Преди предприемане на промяна в терапията лекуващият лекар трябва да се убеди в комплайънса на пациента.Той трябва да подготви индивидуален писмен план за разпознаване на симптомите и действие при екзацербация.
Изработване на индивидуализирани терапевтични схеми
При новооткрити случаи лечението се назначава в зависимост от тежестта на БА с по-ниски или по-високи дози ИКС и бързодействащ симпаткомиметик при нужда. Дозата ИКС се повишава до постигане на контрол и след това се прави опит за „титриране” на дозата до минимална, поддържаща контрола.
При липса на достатъчен контрол при достигане на максимално разрешените дози ИКС може да се премине към комбиниран препарат (ИКС+ДДБА), да се опита и метилксантинов препарат или да се прибави алтернативен противовъзпалителен препарат – монтелукаст, орален кортикостероид, а при случаи на рефрактерна на лечение атопична астма, да се насочи пациентът за лечение с омализумаб (1, 2).
Лечение на екзацербация
Екзацербацията е остро или подостро влошаване на симптомите и белодробната функция, в някои случаи може да бъде първата изява на астмата. Лечението на екзацербацията се състои в последователност от действия предприети от самите пациенти и/или звената за оказване на медицинска помощ -първичните грижи, спешна помощ и болница (1).
При лека и умерена екзацербация инхалиране на БДБА в доза 4-10 впръсвания всеки 20 мин. през първия час обикновено е най-ефективно и достатъчно да повлияе обратимата лимитация на въздушния дебит. Доставянето на БДБА може да бъде чрез pMDI или спейсър, или небулайзер. При добър отговор (ВЕД>60-80% от предвидените или персонално най-добър за 3-4 часа) повече инхалации не са необходими (1).
Системни кортикостероиди се прилагат при влошаване или ако вече е повишена дозата на облекчаващите и контролиращия медикаменти преди пациента да потърси медицинска помощ. Като обективен критерий е ФЕО1или ВЕД под 60% от най-доброто постижение или липса на подобрение за 48 часа. Препоръчителната доза е 50 mg/дневно или 1-2 mg/kg/ дневно за деца 6-11 г. до 40 mg/дневно. Оралните кортикостероиди се препоръчват за 5-7 дни.
Антибиотици не се препоръчват, освен при данни за белодробна инфекция.
Тежката екзацербация е животозастрашаваща и изисква хоспитализация. Тежък астматичен пристъп и астматичен статус не се повлияват достатъчно от бронходилататорно лечение. Ако пациентът е хоспитализиран се привежда в интензивно отделение и при продължаващо влошаване след преоценка се подготвя за интубация и механична вентилация.
Седативните средства, анксиолитици и хипонотични средства строго се отхвърлят по време на екзацербация.
Повлияване на рисковите фактори
1.Създаване на умения и подкрепа за самостоятелно лечение на астмата. Включва самостоятелно проследяване на симптомите и/или ВЕД, писмен план за действие по отношение на астмата и редовни медицински прегледи.
2. Предписване на лекарства или схема, която свежда до минимум екзацербации.
3.Насърчаване избягването на тютюнев дим (активно пушене или тютюнев дим от околната среда).
4. При пациенти с тежка астма насочване пациента към специализиран център за добавянето на лекарства и/или лечение, определено по изследване на храчките.
5. При пациенти с потвърдена хранителна алергия избягване на съответните храни. 6. Осигурена наличност на инжекционен адреналин за употреба при анафилаксия. 7. При млади моносенсибилизирани пациенти обсъждане на специфична десенсибилизация.
Проследяване на пациента след екзацербация
Пациентите се проследяват регулярно след екзацербация, докато симптомите и белодробната функция се нормализират. С повишен риск са пациенти с екзацербация довела до хоспитализация. На проследяващата визита трябва да се провери дали:
- Пациентът разбира причината за изостряне на симптоматиката
- Отстраняване на рисковите фактори, например тютюнопушене
- Придържане към терапията и разбиране необходимостта от прилагането
- Проверка на инхалаторните умения
- Написан план за действие по отношение на астмата
Всички пациенти трябва да имат писмен план за действие по отношение на астмата. Целта е да се покаже на пациента как да разпознава и да реагира при влошаване на астмата. Планът трябва бъде индивидуализиран за обичайните лекарства за астма на пациента; в кои случаи да се повиши облекчаващото и контролиращото лечение или да се започне прием на перорални кортикостероиди; как пациентът да получи достъп до медицинска помощ, ако симптомите не се повлияват (1).
В заключение, лечението на БА е непрекъснат цикъл на оценка, корекция и проверка, чийто успех се гарантира от доверието между пациентите и медицинските специалисти. При комбиниране на самонаблюдение и редовни медицински прегледи, може да се постигне понижаване на смъртността и заболеваемост от БА.
Библиография
1. Global Initiative for Asthma (GINA). Global Strategy for Asthma Management and Prevention. 2016.
2. В. Юрукова. Бронхиална астма. Ред. З. Янкова. Ръководство по пневмология и фтизиатрия; стр. 75-91. София, 2016.
3. В. Юрукова. Персонализирана медицина при бронхиална астма: определяне на фенотипи и ендотипи. Физикална, курортна и рехабилитацинна медицина. 2013;46,бр.1-2: 7-9.
4. В. Юрукова В. Многото лица на бронхиалната астма. Торакална медицина. 2014 ;VI (2):33-43.
5. Agache I, Akdis C, Jutel M, Virchow JC. Untangling asthma phenotypes and endotypes. Allergy 2012; 67(7); 835-46.
6. Campo P, F. Rodrguesz, S. Sanchez-Garcia, et al. Phenotypes and endotypes of uncontrolled severe asthma: new treatments. J Investig Allergol Clin Immunol 2013; 23(3): 76-88.
7. Gibson PG. Inflammatory phenotypes in adult asthma: clinical applications. Clin Respirator J 2009; 3(4): 198-206.
8. Haldar P, Pavord ID. Noneosinophilic asthma: a distinct clinical and pathologic phenotype. J Allergy Clin Immunol 2007; 119(5):1043-1052.
9. Weatherall M. J. Travers, PM Shirtcliffe, SEMarsh, et al. Distinct clinical phenotypes of airways disease defined by cluster analysis. Eur Respir J 2009; 34:812-818.
10. Wenzel SE. Asthma phenopypes: the evolution from clinic to molecular approaches. Nat Med 2012; 18(5):716-25.
11. Mileva Z, Popov T, Staneva M et al. Frequency and characteristics of the allergic diseases in Bulgaria. Allergy and asthma, 2000; 5 (Supl.1): 3-32 [in Bulgarian].
12. Lemiere C, P Ernst, R Olivenstein, et al. Airway inflammation assessed by invasive and noninvasive means in severe asthma & eosinophilic and noneosinophilic phenotypes. J Allergy Clin Immunol 2006; 118(5): 1033-9.
13. Little S, Chalmers G, MacLeod K, et al. Non-invasive markers of airway inflammation as predictors of oral steroid responsiveness in asthma. Thorax 2000; 55: 232-234.
14. Д. Димитрова, В. Юрукова. Съвременно лечение на бронхиална астма. Пулмология и педиатрия. Медикарт 2015, 2: 7-12.
15. Д. Димитрова, В. Юрукова.Тежка астма: определение, имунологична характеристика, молекулярно-таргетна терапия. Торакална медицина 2015, 2: 8-25.
16. Hastie At, WC Moore, DAMeyers, et al. Analyses of asthma severity phenotypes and inflammatory proteins in subjects stratified by sputum granulocytes. J Аllergy Clin Immunol 2010; 125(5): 1028-10360.
17. Schleich F, Maite Manise, Sele J, et al. Distribution of sputum cellular phenotype in a large asthma cohort: predicting factors for eosinophilic vs neutrophilic inflammation. BMC. Pulmonary Medicine 2013, 13, 1-11.
18. Taylor DR. Biomarkers of inflammation in asthma: a clinical perspective. Semin Respir Crit Care Med 2012; 33(6): 62-9.
19. Wang Wen, Huang Ke-wu, Wu , et al. Correlation of eosinophil counts in induced sputum and fractional concentration of exhaled nitric oxide and lung functional in patients with mild to moderate asthma. Chinease Medical Journal 2012;125(17):3157-3160.
20. Xie M, SE Wenzel. A global perspective in asthma: from phenotype to endotype.Clin Med J 2013; 126(1): 166-174.