Брой 4/2011
Доц. д-р Цветин Генадиев, д-р Валя Велева, д-р Даниел Гайдаров
Клиника по урология, УБ „Лозенец”, София
Увод
Брахитерапията е утвърден в световната медицинска практика класически метод за лечение на простатен карцином. Терминът брахитерапия произхожда от гръцката дума brachys, което означава къс, кратък поради прилагане на лечението непосредствено в засегнатия орган. Брахитерапия на простатата е описана за първи път от Pasteau et al. през 1911 г., който въвежда иридиум през уретрален катетър при карцином на простата (1). През 1981 г. H. H. Holm въвежда имплантирането в абдоминални органи под ехографски контрол и развива техника за прецизно поставяне на игли в простатата под трансректална ехография (2). Принципът е в основата на съвременната брахитерапия на простатата.
Видове брахитерапия
Съществуват два вида брахитерапия – с постоянни и с временни импланти. Постоянните импланти осигуряват ниска доза на облъчване за по-дълго време. Временните импланти позволяват еднократно прилагане на висока доза облъчване в простатата – т. нар. високодозова брахитерапия – High Dose Rate (HDR). Тя може да се приложи като монотерапия при пациенти с нисък риск за екстрапростатно разпространение или да бъде допълнена с перкутанна лъчетерапия при пациенти с разпространение на карцинома в капсулата на простатата или около нея (3, 4).
Индикации
Брахитерапията е метод за лечение на локализиран в простатата карцином без данни за далечни метастази. В литературата се определят три групи рискови пациенти за екстрапростатно развитие на карцинома според изходния стадий от биопсията, хистологичната степен по D. Gleason и стойността на простатоспецифичния антиген (ПСА):
Нисък риск – T1c-T2a, Gleason сбор <7 и ПСА <10 ng/ml
Умерен риск T2b, Gleason сбор 7 и ПСА 10–20 ng/ml
Висок риск T2c или повече, или Gleason сбор 8-10 или ПСА >20 ng/ml (5).
Високодозова брахитерапия се прилага успешно и като „спасителна” терапия при локално авансиране на простатен карцином след проведена перкутанна лъчетерапия или след лечение с постоянни импланти (6).
Контраиндикации
Не се срещат абсолютни противопоказания за брахитерапия. Приема се, че методът не е показан при наличие на далечни метастази.
Съществуват относителни противопоказания за брахитерапия. Това са пациенти с обем на простатата над 50 ссм, пациенти след трансуретрална резекция на простатата, пациенти с простатит, пациенти с фрактура на таза. Други автори заключават, че пациенти след трансуретрална резекция на простатата и такива с простатит не са противопоказани за брахитерапия (7, 8).
Усложнения
Високодозовата брахитерапия води до по-незначителни следоперативни усложнения в сравнение с нискодозовата с постоянни импланти брахитерапия (9). При HDR брахитерапията с временни импланти липсват усложнения като тези, предизвикани от мигрирането на имплантите от нискодозовата брахитерапия (10). HDR брахитерапията е с нисък процент на усложнения, дори и комбинирана с перкутанна нискофракционирана лъчетерапия (11). Перинеалната брахитерапия влошава качеството на уриниране при пациенти с предхождащи обструктивни симптоми (12).
Въвеждане на брахитерапия на простатата в България
В България досега не е извършвана брахитерапия на простатна жлеза. Въвеждането на метода стана възможно благодарение на реализиране на Научноизследователски проект № РНФ01/0135 на тема : „Рак на простатната жлеза – диагноза, прогноза, лечение и оценка на лечебните резултати и усложнения”. Участници в проекта са Клиниката по лъчелечение на СБАЛО, София, Клиниката по урология на УБ „Лозенец”, София, и НЦРРЗ, София. След осигуряване на необходимата апаратура и провеждане на обучение на участниците започна прилагането на интерстициална високодозова с временни, само по време на манипулацията импланти – брахитерапия при карцином на простатата.
Първият случай на високодозова интерстициална простатна брахитерапия в България се извърши на 6 октомври 2010 г. в Клиниката по лъчелечение на СБАЛО, София. Пациент Б. Н. Ч., на 63 години, с ПСА 25 ng/ml, Gleason 7. Гост-оператор от Швеция д-р Бенгт Йохансон.
Принцип на метода
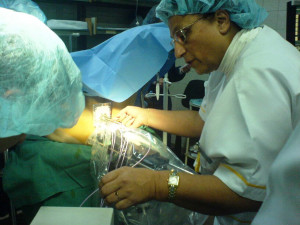
Брахитерапията се извършва от екип физици, лъчетерапевти и уролози. Пациентът се въвежда в обща интубационна или регионарна анестезия. Поставя се в положение за „литотомия” – фиг. 1. Предварително е приложена лаксативна подготовка и почистване на перинеума.
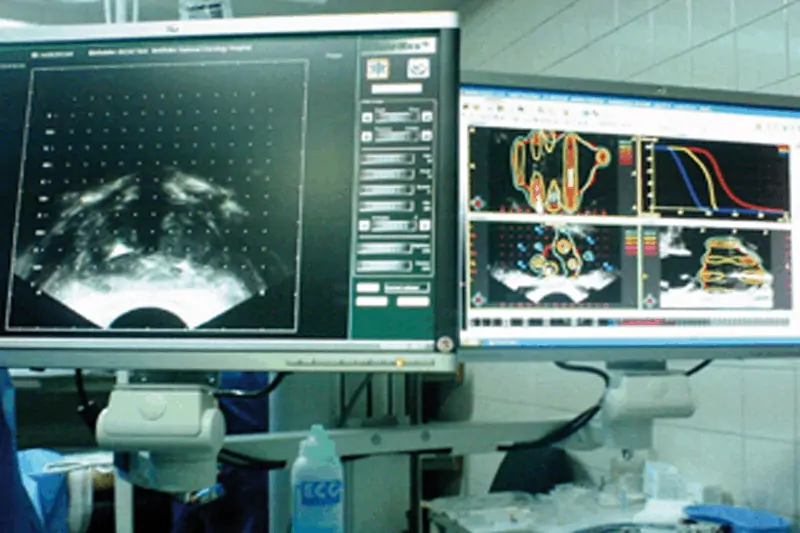
В началото на манипулацията се извършва трансректално сканиране на простатата, от което се избират три образа – основа, референтен план и апекс. Образите се въвеждат в компютърна система за планиране на процедурата. Определят се уретрата и ректумът. След въвеждане на данните се получава оценка от компютъра за процентите успех на процедурата. Посочват се и броят на катетрите и мястото им в простатата.
Пред перинеума се поставя плочка с перфорирани отвори (темплейт), съответстващи на „решетката” на образа на ехографския монитор. Временните импланти – игли – се поставят в последователност и местоположение, определени от компютъра. Всяка поставена игла се регистрира от компютъра.
След поставяне на временните импланти (иглите) те се свързват по ред всяка самостоятелно с радиоактивния източник – фиг. 5.
Фиг. 5. Свързване на иглите с радиоактивен източник
По определен ред във всяка игла прониква радиоактивен електрод, който излъчва лъчение в участъци от „иглата”, определени от компютъра. В края на облъчването иглите се отстраняват от перинеума. Компресивна превръзка. Обезболяване в първите часове след манипулацията при необходимост. Най-често липсва значителна болка. Антибиотична профилактика с ципрофлоксацин перорално за 10 дни. Пациентът се изписва на следващия ден. При монотерапия се извършват две или три процедури през интервал от 14-20 дни. При комбинирана терапия се прилага и допълнителна перкутанна лъчетерапия.
Първи оперативни и ранни следоперативни резултати
Високодозова интерстициална брахитерапия на простата с временни импланти при простатен карцином извършихме при трима пациенти с доказан биопсично простатен карцином. Средна възраст 65 години. Средна стойност на ПСА 18 ng/ml. Среден обем на простатата 40 ссм. Всички пациенти проведоха предоперативна пълна андрогенна блокада за три месеца. При четвъртия пациент поради анатомична особеност на илиачните кости беше невъзможно поставяне на иглите в правилна позиция и не се извърши брахитерапия. При всички пациенти на първата процедура имаше хематурия, която налагаше постоянна промивка на уретралния катетър за 24 часа. Не сме наблюдавали големи усложнения – кръвозагуба, хемотампонада или други. На следващия ден уретралният катетър се сваля и след спонтанна микция пациентът се изписва от клиниката.
Заключение
Високодозовата интерстициална брахитерапия с временни импланти е минималноинвазивен метод за лечение на карцином на простатата. Въвеждането на метода в българската медицинска практика определяме като значителен принос за нашата медицина. Методът е нова възможност за пациентите с простатен карцином да бъдат лекувани съвременно със запазване качеството на живот. Високодозовата с временни импланти брахитерапия не води до трайни промени в околните на простатата тъкани, поради което късната, спасителна, радикална простатектомия се извършва с минимален риск от усложнения. Увеличаването броя на случаите ще определи предимствата и недостатъците на метода в нашата практика.
Библиография
1. Pasteau O. Traitment du cancer de la prostate par le Radium. Rev Malad Nutr, 1911, 363-367.
2. Holm H. H. The history of interstitial brachytherapy of prostatic cancer Semin Surg Oncol. 1997 Nov-Dec, 13 (6), 431-7.
3. Demanes D. J., A. A. Martinez, M. Ghilezan , D. R. Hill, L. Schour, D. Brandt , G. Gustafson. High-Dose-Rate Monotherapy: Safe and Effective Brachytherapy for Patients with Localized Prostate Cancer. Int. J. Radiat Oncol Biol Phys., 2011.
4. Hsu I. C., A. R. Cabrera, V. Weinberg, J. Speight, A.R. Gottschalk, M. 3rd. Roach, K. Shinohara. Combined modality treatment with high-dose-rate brachytherapy boost for locally advanced prostate cancer. Brachytherapy, 2005, 4 (3), 202-6.
5. D’Amico A. V., J. Moul, P. R. Carroll et al. Cancer-specific mortality after surgery or radiation for patients with clinically localized prostate cancer managed during the prostate-specific antigen era. J. Clin. Oncol., 2003, 21, 2163-2172. Int. J. Radiat Oncol. Biol. Phys., 2005 Oct 1, 63 (2), 463-71.
6. Tharp M., M. Hardacre, R. Bennett, W. T. Jones, D. Stuhldreher, J. Vaught. Prostate high-dose-rate brachytherapy as salvage treatment of local failure after previous external or permanent seed irradiation for prostate cancer. Brachytherapy, 2008 Jul-Sep, 7 (3), 231-6.
7. Luo H. L., F. M. Fang, Y. C. Chuang, P. H. Chiang. Previous transurethral resection of the prostate is not a contraindication to high-dose rate brachytherapy for prostate cancer. BJU Int., 2009 Dec, 104 (11), 1620-3.
8. Aggarwal S., K. Wallner, L. D. True, K. Russell, S. Sutlief, J. Blasko, W. Ellis. Prostate brachytherapy in patients with prior evidence of prostatitis. Int. J. Radiat Oncol. Biol Phys., 1999 Nov, 1, 45 (4), 867-9.
9. Grills I. S., A. A. Martinez, M. Hollander, R. Huang, K. Goldman , P. Y. Chen, G. S. Gustafson. High dose rate brachytherapy as prostate cancer monotherapy reduces toxicity compared to low dose rate palladium seeds. J. Urol., 2004 Mar, 171 (3), 1098-104.
10. N. Di Muzio, MD 1 B Longobardi, PhD 2 A Losa, MD 3 P Mangili, PhD 2 L D Nava, MD 3 P Rigatti, MD 4 R Calandrino, PhD 2 E Villa, MD 1 and G Guazzoni, MD.Seed migration in prostate brachytherapy: a re-implant case report. British Journal of Radiology, 2003, 76, 913-915.
11. Akimoto T., K. Ito, J. Saitoh , S. E. Noda, K. Harashima, H. Sakurai, Y. Nakayama, T. Yamamoto, K. Suzuki, T. Nakano, H. Niibe. Acute genitourinary toxicity after high-dose-rate (HDR) brachytherapy combined with hypofractionated external-beam radiation therapy for localized prostate cancer: correlation between the urethral dose in HDR brachytherapy and the severity of acute genitourinary toxicity. Int. J. Radiat Oncol. Biol Phys., 2005 Oct 1, 63 (2),463-71.
12. Mallick S., R. Azzouzi, L. Cormier, D. Peiffert, P. H. Mangin. Urinary morbidity after 125I brachytherapy of the prostate. BJU Int., 2003 Oct, 92 (6), 555-8.