Брой 1/2017
Д-р М. Михайлов, доц. д-р В. Юрукова, д.м.
Клиничен Център по Белодробни болести, СБАЛББ ”Света София” ЕАД
Медицински Университет – София
Резюме
Бронхиалната астма и ХОББ са хетерогенни заболявания, характеризиращи се със системно хронично възпаление.
При класическите случаи на БА и ХОББ разграничаването на пациентите е сравнително лесно, но в реалната практика често се наблюдава припокриване на отделни характеристики на двете болести, което затруднява точната диагноза. Около 15% от пациентите с персистираща обструкция имат припокриване между ХОББ и астма.
Синдромът на припокриване астма и ХОББ (ACOS) се определя като персистираща обструкция и едновременно наличие на типични за БА и ХОББ характеристики.
Все още няма утвърден обективен биомаркер за ACOS, поради липсата на достатъчно категорични доказателства. Неутрофилният желатиназа-асоцииран липокалин (Neutrophil gelatinase-associated lipocalin – NGAL) се очертава като един от най-обещаващите биомаркери от ново поколение. Повишени серумни нива на NGAL са наблюдавани при ACOS с положителна корелация със серумните нива на IgE, кръвни неутрофили и CRP.
ACOS все още е синдром с недостатъчно уточнени диагностични критерии и са необходими проучвания за валидирането на надежни биомаркери, които да предиктират прогресия на заболяването и отговор на специфично лечение.
Въведение
Обструктивните белодробни болести, които са основна част от белодробната патология, се изучават особено интензивно през последните години, поради голямото си медико-социално значение. Тревожна e тенденцията за постоянното нарастване на заболеваемостта, смъртността и на икономическия и финансов товар, поради засягане на все по-голяма част от населението в активна възраст (1).
Според GOLD 2017 Хроничната обструктивна белодробна болест (ХОББ) е често срещано предотвратимо и лечимо заболяване, което се характеризира с персистиращи респираторни симптоми и ограничение на въздушния поток, породени от промени в дихателните пътища и/или алвеолите, обикновено развили се в резултат на токсични частици или газове (2).
От своя страна бронхиална астма (БА) е хетерогенно заболяване, което се характеризира с хронично възпаление на дихателните пътища и се определя от анамнеза за променливи във времето и по тежест респираторни симптоми като свирене и стягане в гърдите, задух, кашлица и непостоянна бронхиална обструкция (3).
Хетерогенност на ХОББ и БА
ХОББ и БА са хетерогенни заболявания, съставени от множество различни субгрупи. Фенотип са видимите характеристики на организма или заболяването, формиращи се в резултат на взаимодействието между гените и заобикалящата среда.
Установяват се групи пациенти с чести екзацербации, като този фенотип остава устойчив във времето. Част от пациентите с ХОББ не показват прогресия на спада на ФЕО1, а дори при малка група се наблюдава подобрение в белодробната функция за период от три години, докато при трета група пациенти се наблюдава извънредно бърз спад. От друга страна ФЕО1 корелира слабо със симптомите, здравния статус, коморбидните състояния и бъдещия риск (4).
Miravitles et al. публикуват обзор на проучванията върху отделни фенотипи на ХОББ, като акцентират върху онези, които имат значение за прогнозата и терапевтичното повлияване на болестта. Авторите извеждат три основни клинични фенотипи на ХОББ – смесен фенотип ХОББ – БА (5), чести екзацербатори и емфизем с хиперинфлация (6).
Начало на подобно фенотипно насочено лечение се открива и в GOLD, където се предлага различен подход при пациенти с повече симптоми и висок риск от екзацербации (7).
Внимание на отделните фенотипи при астма е обърнато и в GINA, като при пациенти с по-тежка астма се препоръчва специфично лечение за определени групи. Така например астмата с късно начало, свързана със затлъстяване или развитие на фиксирана обструкция, би могла да наподобява функционално ХОББ, да има леко еозинофилно възпаление и лош терапевтичен отговор към инхалаторни кортикостероиди (8).
При класическите случаи на БА и ХОББ, разграничаването на пациентите е сравнително лесно, но в реалната практика често се наблюдава припокриване на отделни характеристики на двете болести, което затруднява точната диагноза.
Поради тази причина през 2014 г. международните комитети за БА и ХОББ публикуват общ документ, разглеждащ синдрома на припокриване на астма и ХОББ (Asthma-COPD overlap syndrome, ACOS). Според тях ACOS се определя като персистираща обструкция и едновременно наличие на типични за БА и ХОББ характеристики (5).
Около 15% от пациентите с персистираща обструкция имат припокриване между ХОББ и астма (9).
Според скорошни данни ACOS по-вероятно е сбор от „болести“ с различни клинични фенотипове (напр. наличие на съпътстващи заболявания), възпалителни биосигнатури и патогенеза (напр. Т-хелпер тип 2 възпаление или Т хелпер тип 1 възпаление в дихателните пътища)(10,11). В тази насока са необходими още изследвания.
Характеристика на ХОББ, БА и ACOS
Отличителна функционална характеристика на пациентите с ACOS e наличието на трайно понижено съотношение ФЕО1/ФВК<0.7 в съчетание с добър бронходилататорен или терапевтичен отговор, обикновено > 12% и 200 ml, но нерядко > 15% и 400 ml подобрение на ФЕО1.
Диагноза
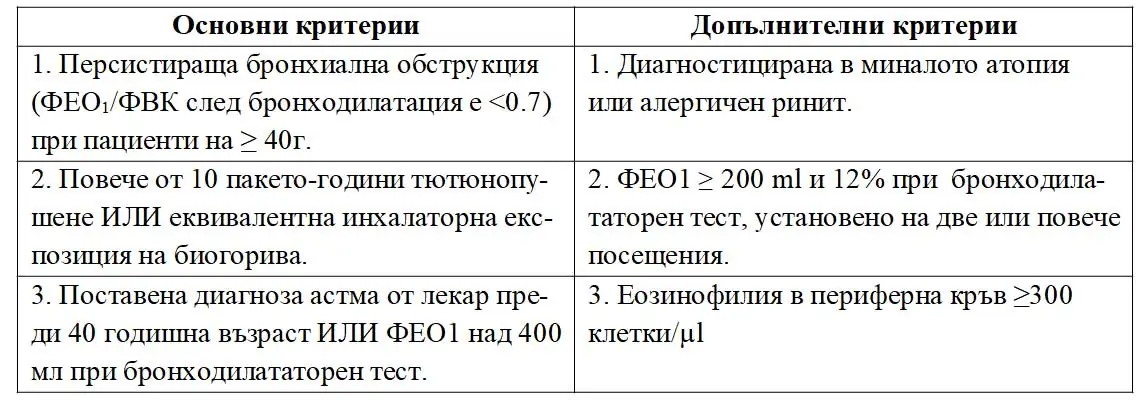
Според Sin, et al 2016 (12), основни черти на ACOS са: 1. Персистираща бронхиална обструкция установена със спирометрия, след приложение на краткодействащ бронходилататор при пациенти на или по-възрастни от 40 г.; 2. Дългогодишно тютюнопушене или инхалаторна експозиция на биогорива; 3. Поставена диагноза астма от лекар преди 40 годишна възраст.
Те формулират следните критерии, за поставяне на диагноза ACOS (табл.2.).
Диагнозата се приема при наличие на трите основни и поне един допълнителен критерий.
Табл.2 Диагностични критерии за ACOS (12)
Маркери на възпалението при ХОББ и БА
ХОББ и БА са възпалителни заболявания на белия дроб (7,8).
При БА възпалението е алергично и се наблюдава променен имунен отговор спрямо широко разпространени алергени при генетично предразположени индивиди, като ключова роля се пада на цитокините, отделени от Th2 лимфоцитите (IL-4, IL-5 и IL-13), които регулират растежа и активирането на еозинофилните левкоцити (Ео) и мастоцити, синтезата на IgE, последващото освобождаване на специфични антиген-свързани хемокини като еотаксин, RANTES и др., както и експресията на ендотелни адхезионни молекули (13).
При ХОББ възпалението в дихателните пътища представлява патологично усилен отговор срещу прекомерния оксидативен стрес, който се развива при персистиращото действие на увреждащата външна нокса. Доминиращ е клетъчен тип възпаление, което се състои от макрофаги, неутрофилни левкоцити и цитотоксични CD8+ лимфоцити от типа Tс1. Основните активни цитокини са неутрофилните хемотактични медиатори – IL-8, левкотриен В4 (14).
С прогресиране и засилване на тежестта на болестта, възпалението при ХОББ и БА придобива сходни характеристики – увеличава се броя на неутрофилите, нуждата от кортикостероиди и се развива относителна стероидна резистентност (15). При част от пациентите с ХОББ се установява увеличаване на броя на еозинофили в дихателните пътища по време на екзацербации, като лечението с ИКС редуцира сигнификантно тяхната честота (16). При друга подгрупа с ХОББ и хроничен бронхит е установено задебеляване на базалната мембрана и повишен брой Ео в БАЛ – промени, които се считат типични за БА (15).
От друга страна, броят на неутрофилите в индуцирана храчка при астматици е в пряка връзка с тежестта на обструкцията. Други автори установяват, че повишеният брой Ео и неутрофили е свързан с нисък пре-бронходилататорен ФЕО1, но само високия брой неутрофили се свързва с лош бронходилататорен отговор (17).
От тези данни може да се предположи, че пациентите с ACOS могат да се разглеждат като такива с ХОББ, Ео възпаление и по-изразен бронходилататорен отговор или пациенти с БА, но със сигнификантно неутрофилно възпаление и непълна обратимост на обструкцията.
Все още няма утвърден обективен биомаркер за ACOS, поради липсата на достатъчно силни доказателства.
Броят на еозинофили в кръвта (лесно измерване и стандартизация) се свързва с риск за екзацербация (18) и отговор към инхалаторни кортикостероиди (19). Понастоящем при ACOS, не са установени референтните граници на този маркер, но най-често се посочва 2% (21, 20, 19).
Серумните нива на IgE (стандартизиран метод на измерване) също са сред потенциалните биомаркери за ACOS, но поради малкото налични изследвания все още не са включени в препоръките за диагностика на ACOS (12).
Нивата на медиатори на възпалението (участващи при възпалението) в кръвта, биха могли да се използват като маркери за оценка на активността на болестта, индивидуализиране на лечебния подход и определяне риска за по-нататъшното увреждане на белия дроб.
Неутрофилният желатиназа-асоцииран липокалин (Neutrophil gelatinase-associated lipocalin)(NGAL) представлява 25кDa липокалин, първоначално изолиран от човешки неутрофили (22). Принадлежи към семейство малки белтъци (липокалини), ангажирани с трансмембрания транспорт на липофилни съединения (23). NGAL нормално се експресира в различни тъкани у възрастния индивид, в това число костен мозък, простата, слюнчени жлези, стомах, дебело черво, трахея, бял дроб, черен дроб и бъбрек. Някои от тези тъкани често са изложени на влиянието на микроорганизми и експресират ниски нива на NGAL протеин.
NGAL се очертава като един от най-обещаващите биомаркери от ново поколение. Той се прилага като биомаркер за оценка на бъбречната функция (24), като през последната година се водят проучвания за чувствителността му при белодробни болести и по-точно при ACOS. Serap Duru et al наблюдават повишени нива на серумен NGAL при групи от пациенти с Астма, ХОББ и ACOS. Повишените серумни нива на NGAL при ACOS са в положителна корелация със серумните нива на IgE, кръвни неутрофили и CRP (25).
Лечение
Изборът за начална терапия се основава на ефикасност и безопасност.
Започва се с ниска доза ИКС, ако оценката на симптомите предполага, че се касае за БА. Ако контролът остава лош, въпреки придържане към терапията и правилна техника, се добавя дългодействащ бета2-агонист (ДДБА) и/или дългодействащ мускаринов рецепторен антагонист (ДДМА). Не се провежда самостоятелно лечение с ДДБА без ИКС.
Ако оценката на симптомите предполага, че се касае за ХОББ се започва терапия с бронходилататори или комбинирана терапия. Не се назначават ИКС самостоятелно без ДДБА и/ или ДДМА.
Ако диференциалната диагноза е балансирана между астма и ХОББ, т.е. ACOS, се започва лечение за БА. Началното лечение е с ИКС в ниска или умерена доза. Обикновено се добавя ДДБА и/или ДДМА.
За всички пациенти с хронични обструктивни белодробни болести се препоръча спиране на тютюнопушенето, лечение на придружаващите заболявания, физическа активност при ХОББ или ACOS, белодробна рехаблитация и ваксинация.
Заключение
Налични са множество доказателства за системно възпаление при ХОББ и БА. На клетъчно и молекулярно ниво обструктивните белодробни болести са сложни и хетерогенни заболявания. Прецизирането на биомаркери може да подобри точността на клиничните изследвания, като с това да се установят патологично променените сигнални пътища, върху които може да се въздейства с лечението.
ACOS все още е синдром с недостатъчно уточнени диагностични критерии и са необходими проучвания за валидирането на надежни биомаркери, които да предскажат прогресия на заболяването и отговор на специфично лечение.
Литература:
1. Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2015. Available from: https://goldcopd.org/
2. Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2017. Available from: https://goldcopd.org/.
3. Global Strategy for Asthma Management and Prevention, Global Initiative for Asthma (GINA) 2016. Available from: https://ginasthma.org
4. Agusti A, et al. Characterisation of COPD heterogeneity in ECLIPSE cohort. RespirRes 2010, 11:122.
5. Asthma, COPD and Asthma-COPD Overlap Syndrome (ACOS). Based on the Global Strategy for Asthma Management and Prevention and the Global Strategy for the Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease. 2014
6. Miravitles M, et al. Clinical Phenotypes of COPD: Identification, Definition and Implications for Guidelines. ArchBronconeumol 2012; 48:86-98.
7. Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2014. Availablefrom: https://goldcopd.org/
8. Global Strategy forAsthma Management and Prevention, Global Initiative for Asthma (GINA) 2014. Available from: https://ginasthma.org
9. Cosio BG, Soriano JB, Lopez-Campos JL, etal. Defining the asthma-COPD overlap syndrome in a COPD cohort.Chest 2016; 149: 45–52
10. Tho NV, Park HY, Nakano Y. Asthma-COPD overlap syndrome (ACOS): a diagnostic challenge. Respirology 2016;21: 410–418;
11. Postma DS, Rabe KF. The asthma-COPD overlap syndrome. N Engl J Med 2015; 373: 1241–1249
12. Sin D.D., Marc Miravitlles, David M. Mannino, et al. What is asthma−COPD overlap syndrome? Towards a consensus definition from a round table discussion. European Respiratory Journal Jun 2016, ERJ-00436-2016; DOI: 10.1183/13993003.00436-2016
13. Hogaboom CM etal. The Role of Chemokines in Asthmatic Airway Responses. In: Strieter R, Kunkel S, Standiford T (eds). Chemokinesinthelung. MarcelDeckerIns. New York 2003;81-98.
14. Brown Z, Campbel EM. Chemokinesin Chronic Obstructive Pulmonary Disease. In: Strieter R, Kunkel S, Standiford T (eds). Chemokinesinthelung. Marcel Decker Ins. New York 2003;99-112
15. Peter H. LenzandRalph J. Panos (2014). Asthma and COPD – Overlapping Disorders or Distinct Processes?, COPD Clinical Perspectives, Prof. RalphPanos (Ed.), InTech, DOI: 10.5772/58234.
16. Bafadhel M, McKenna S, Terry S, et al. Acute exacerbations ofchronic obstructive pulmonary disease: identification of biologic clusters and their biomarkers. Am J RespirCrit Care Med 2011; 184: 662–671.
17. Fahy J. Eosinophilic and Neutrophilic Inflammation in Asthma. ProcAmThorac Soc2009; 6: 256–259.
18.Vedel-Krogh S, Nielsen SF, Lange P, et al. Blood eosinophils and exacerbations in COPD: the Copenhagen General Population Study. Am J Respir Crit Care Med 2016; 193: 965–974
19. Pascoe S, Locantore N, Dransfield MT, et al. Blood eosinophil counts, exacerbations, and response to the addition of inhaled fluticasone furoate to vilanterol in patients with chronic obstructive pulmonary disease: a secondary analysis of data from two parallel randomised controlled trials. Lancet Respir Med 2015; 3: 435–442
20. Pavord ID, Lettis S, Locantore N, et al. Blood eosinophils and inhaled corticosteroids/long-acting beta-2 agonist efficacy in COPD. Thorax 2016; 71: 118–125
21. Bafadhel M, Davies L, Calverley PM, et al. Blood eosinophil guided prednisolone therapy for exacerbations of COPD: a further analysis. Eur Respir J 2014; 44: 789–791.
22.Kjeldsen L, Cowland JB, Borregaard N. Human neutrophil gelatinase-associated lipocalin and homologous proteins in rat and mouse. Biochim Biophys Acta. 2000 Oct 18;1482(1-2):272-83.
23.Kalousek I, Röselová P, Otevrelová P. NGAL–neutrophil gelatinase associated lipocalin in biochemistry, physiology and clinical praxis. Cas Lek Cesk. 2006;145(5):373-6. Review.
24.Христова Ж, Цачев К. Нови структурни биомаркери за оценка на реналната функция и ранно диагностициране на остро бъбречно увреждане. Медицински Преглед, 2013;49(4): 5-13.
25. Akçali SD, et al. Human neutrophil gelatinase-associated lipocalin: A new biomarker in asthma-COPD overlap syndrome. Eur Respir J Sep 2016, 48 (suppl 60) PA5014; DOI: 10.1183/13993003.congress-2016.PA5014