Брой 4/2021
Пациентска анамнеза:
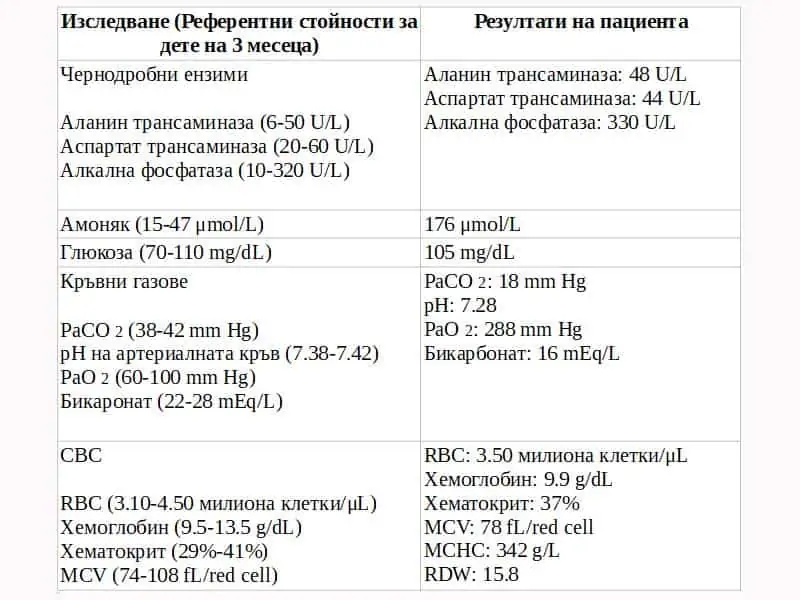
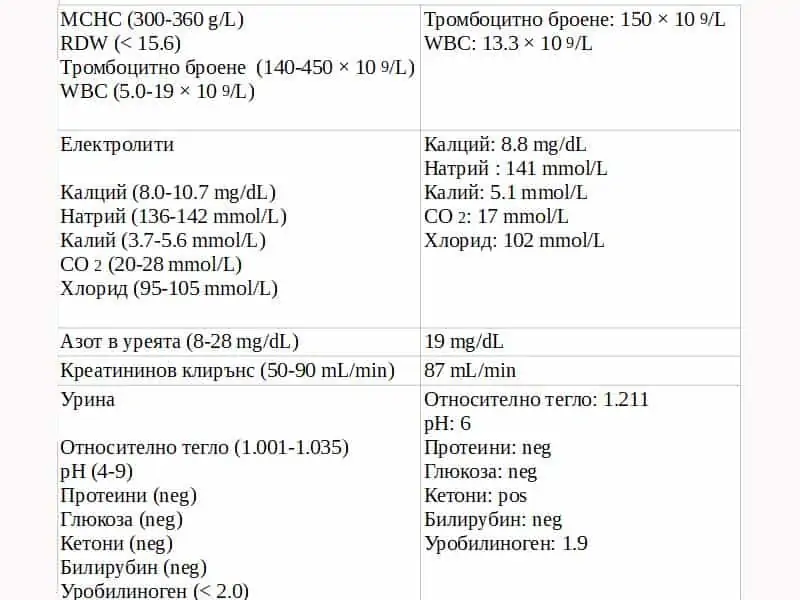
В спешно отделение (ED) е доведено кърмаче на 3 седмици с летаргия, респираторен дистрес и повръщане. Родителите съобщават, че през изминалите няколко часа то не реагира подобаващо на звуци и други влияния, не се храни добре и изглежда, че е със “забавени действия“. От няколко часа не движи по нормален начин крачетата си и ги гърчи неволно. Наблюдава се тремор на ръцете и краката. Приложена е кислородна маска, както и са назначени допълнителни изследвания. Направената рентгенова снимка не показва отклонения от нормата. Назначени са лабораторни изследвания (табл. 1). Резултатите от последните показват понижени хидрогенкарбонати HCO3, повишени нива на анийнонната дупка и повишено ниво на амоняк. Поставена му е интравенозно (IV) канюла и е приложена 10% декстроза с електролити в доза 10 mg/kg/min. Назначават се допълнителни изследвания, вкл. газов състав на артериалната кръв (ABG) и изследвания за функцията на черния дроб. (табл. 1).
Табл. 1 Лабораторни резултати на пациента
CBC = пълна кръвна картина; MCHC = средна корпускулярна концентрация на хемоглобин; MCV = среден корпускулярен обем; RBC = червени кръвни клетки; RDW = ширина на разпределение на червени кръвни клетки WBC = бели кръвни клетки
Въпрос:
Коя от следните изброени следващи стъпки е подходяща, съобразно състоянието на детето?
- Ако дишането му е стабилно – изписване с указания за последващ преглед при неговия педиатър на следващия ден
- В този момент най-добре би било то да бъде наблюдавано в ED още няколко часа преди да се вземе решение
- Приемане в болница за наблюдение през цялата нощ
- Приемане в болница и консултация със специалист
Верен отговор: Приемане в болница и консултация със специалист
Лабораторните резултати показват, че детето е с данни за метаболитна ацидоза. То трябва да бъде прието в по спешност в болница и състоянието му да бъде преценено от специалист – лекар, специализиран в метаболитни нарушения, ако има такъв.
Метаболитна ацидоза и хиперамониемия
На всяко критично болно новородено, кърмаче, дете, юноша или възрастен с летаргия, тахипнея и повръщане трябва да се направят изследвания, които да помогнат да се идентифицира риска от метаболитно нарушение. Тези изследвания включват определяне на киселинно-основните нива чрез използване на анализ на газовете в кръвта, а така също и определяне дали дадения индивид има хиперамониемия, наличие на кетони, и най-накрая – дали глюкозата му е нормална. Ако резултатите на някое от тези скрийнинг изследвания са абнормални, важно е да се определи причината. Ако е налична хиперамониемия, трябва да се получат плазмените нива на аминокиселините, ацилкарнитиновия профил на кръвта или плазмата и нивата на органичните киселини в урината (ако е възможно включително оротна киселина, ако се подозира разтройство в метаболитния цикъл на уреята). Често диференциалната диагноза на метаболитните причини на хиперамониемия може да бъде разделена според резултатите на газовете в кръвта в 2 основни категории: тези, с метаболитна ацидоза – предимно органичните ацидемии; и тези с респираторни алкалози – предимно с дефекти на ензими в цикъла на производство уреята. Това са временни изключения към тази категоризация, така че аминокиселините в плазмата, нивата на органични киселини и ацилкарнитин профили са също полезни.
Острите промени в неврологичния статус (напр. мозачен удар, припадък, енцефалопатия) дават основание за извършване на нервообразна диагностика, а също така и трябва да се обмисли консултация с педиатър-невролог. Ако пациентът е летаргичен/коматозен, или съществува подозрение за субклинични припадъци/неконвулсивен статус епилептикус, трябва да се направи електроенцефалограма.
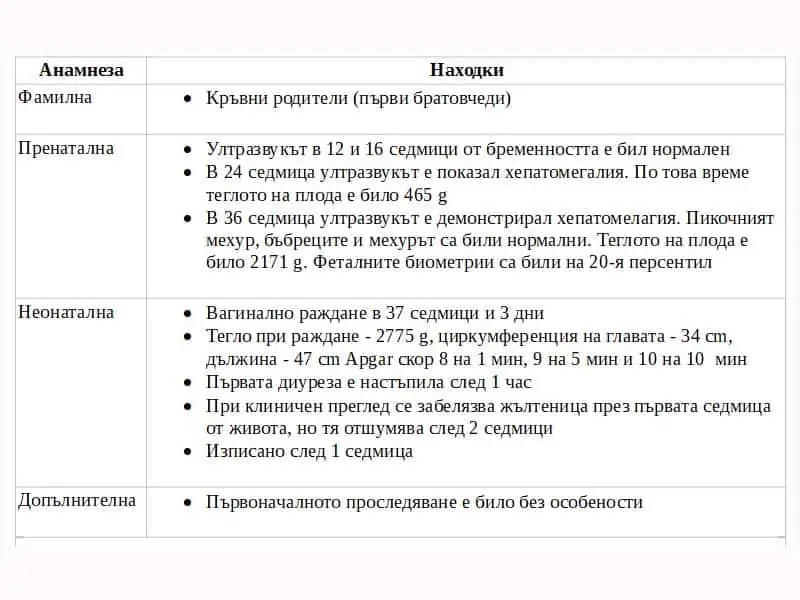
Детето е прието в болница и прегледано от педиатър, който също разглежда анамнезата му (табл. 2). Хроматограмата на аминокиселините в плазмата показва повишения на глицина и лизина. Ацилкарнитиновият му профил демострира повишено ниво на пропионилкарнитин (C3) и повишено съотношение пропионилкарнитин – ацетилкарнитин (C3/C2). Органичните киселини в урината демонстрират повишение на 3-хидроксипропионат и метилцитрат.
Въпрос:
Въз основа на анамнезата, получените в момента резултати и клинична презентация, коя от следните работни диагнози би била подходяща?
- Дефицит на основна мастна киселина
- Пропионова ацидемия (PA)
- Хипервалинемия Пропионова ацидемия
- Метаболитен дефект с липса на пикочна киселина
Верен отговор: Пропионова ацидемия (PA)
Наличието на метаболитна ацидоза с анийнонна дупка е постоянна при детето, което има органична ацидемия. Наличието на повишени C3 нива, метилцитрат и 3-хидроксипропионат без метилмалонна ацидемия показва, че то има PA. Фактът, че родителите му са първи братовчеди е фактор, повишаващ подозрението за автозомно рецесивно нарушение каквото е PA. Хиперамониемията също подсказва тази диагноза.
Пропионова ацидемия (PA)
PA е автозомно рецесивно, наследствено нарушение, причинено от дефективна форма на ензима пропионил-коензим A (CoA) карбоксилаза. Дефектът/липсата на CoA се изразява в натрупване на пропионова киселина. При такива пациенти може да се появи повръщане, дехидратация, летаргия и енцефалопатия.
Първоначалните лабораторни изследвания показват метаболитна ацидоза с анионна пролука, хипогликемия, хиперамониемия и кетонурия. Трябва да се елиминират общите причини за кетоциадоза и лактатна ацидоза преди да се установи диагноза PA. При ацидоза често са налични припадъци, диабет, алкохолна кетоациадоза, чернодробно заболяване, шок, аноксично или исхемично увреждане на тъканите (или двете).
Фактът, че детето има еднокръвни роднини показва, че трябва да се имат предвид автозомни рецесивни нарушения. Широк диапазон от общи заболявания се наблюдава по-често при еднокръвни популации, вкл. захарен диабет, рак, нарушения на кръвта, ментални нарушения, сърдечни заболявания, астма, гастроинтестинални (GI) смущения, хипертензия, дефицит на слуха и чести очни заболявания. Трябва да се отбележи, че въпреки че не са много чести в САЩ, пациенти с еднокръвни родители се срещат в клиничната практика. Оценено е, че глобално около 8.5% от децата имат еднокръвни родители.
Дефектите в цикъла на уреята са често причина за хиперамониемия, но трябва да се имат предвид други причини. Например, лечение с някои лекарства като валпроат и карбамазепин могат да се свържат с хиперамониемия. Друга потенциална причина за хиперамониемия е синдромът на Рей, придобито нарушение, настъпващо обикновено след вирусна инфекция (главно грип A или B или варицела). При пациенти със синдром на Рей се проявяват симптоми, включващи повръщане, променено ниво на съзнание, припадъци, церебрален едем и хепатомегалия без жълтеница.
В този случай новото начало на треморите при пациента представляват допълнителни указатели към диагнозата PA. Според клиничните доклади PA трябва да се има предвид при пациенти с нови хореоатетоидни движения, дори ако липсват традиционните симптоми на метаболитна декомпенсация.
Ако клиничната картина подсказва метаболитна ацидоза, може да се направи предполагаема диагноза, въз основа анализ на кръвта, на нивата на амоняк, аминокиселини и органични киселини. Серумните нива на амоняк, глицин, β-хидроксибутират и ацетоацетат трябва да са повишени. При пълна кръвна картина може да се открият неутропения и тромбоцитопения. Също така ще бъде повишен C3 пропионилкарнитина. Стойността на нормалната анионна пролука е между 8 и 12; анионна пролука, по-голяма от 15 е „повишена.“ Анионната пролука се изчислява по формулата Na – (Cl + HCO 3). Лечението на метаболитната ацидоза трябва да започне веднага при проява, без да се чакат резултатите от теста за потвърждение.
Оротната киселина помага за определяна на диференциалнаа диагноза на хиперамонемични нарушения. Нормалните нива на оротната киселина в урината се понижават сигнификантно с възрастта. Най-високата граница (на 99-я персентил) за пациенти на възраст от 3 дни до 1 година е около 3.44 mmol/mol креатинин. Във възрастта от 1 до 12 години тя се понижава до 1.30 mmol/mol креатинин.
Диагнозата PA се потвърждава когато при молекулярно-генетично изследване се открие патогенен вариант в PCCA или PCCB гена, или когато има недостатъчна/липсваща пропионил-CoA карбоксилазна (PCC) ензимна активност. Ако молекулярното изследване е двусмислено, ще е нужна може би комбинация от ензимно и молекулярно изследване.
Диагнозата PA е потвърдена от генетични изследвания, които показват мутация в PCCB.
Въпрос
Кой от долуизброените компоненти е подходящ дългосрочен режим на лечение за този пациент?
- Ниско протеинна диета
- Урзодеоксихолична киселина
- Инсулин
- Суплементиране с Витамин B12
Верен отговор: Ниско протеинна диета
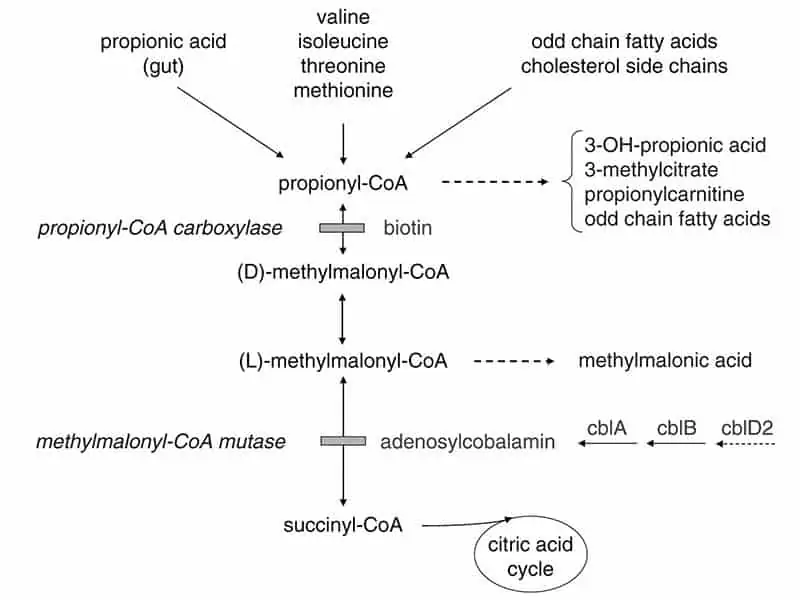
Ниско протеинната диета е съществен компонент при лечение на пациенти с PA. Пациентите с PA са неспособни да метаболизират 4 аминокиселини (валин, изолевцин, треонин и метионин), мастни киселини с въглеродни вериги с нечетен брой атоми и холестерол (фиг. 1). При лечение на остра форма на PA приемът на протеин трябва да се проведе за не по-малко от 24 часа. В допълнение, трябва да се вземат подходящи калории за предпазване от катаболизъм (загуба на мускулна маса).
Фигура 1. Метаболитна взаимовръзка на MMA и PA
Creative Commons Attribution Licenses 4.0. Baumgartner MR, et al. Orphanet J Rare Dis. 2014;9:130.
https://creativecommons.org/licenses/by/4.0/
MMA = methylmalonic acidemia
Лечение
При лечение на остра форма на PА набавянето на подходящи калории чрез използване на интравенозна течност, съдържаща декстроза и по възможност липиди, е съществено за лечение на дехидратация и превенция на катаболизъм. При остра форма трябва да се дават винаги течности, съдържащи декстроза и електролити, ако оралната хидратация е недостатъчна. Приемът на протеини може да стане до 24 часа.
Интервенциите трябва да се насочат към лечение на метаболитна ацидоза, абнормалности в глюкозата и хиперамониемия. Трябва да се избягва употребата на Рингер лактатен разтвор. В допълнение, трябва да се прилага интравенозно карнитин в 100 mg/kg/d, разделен на всеки 8 часа (максимално 5 g/d), заедно с биотин (10 mg/d).
Трябва да се обмисли хемодиализа при изключително високи нива на амоняк и тя е определено индицирана при пациенти в кома. Смъртността при пациенти с PA е свързана със степента на ацидоза и хиперамониемия, водещи до кома и смърт.
В острата фаза пациентите трябва да се мониторират за признаци на повишено вътречерепно налягане. Ако съществуват някакви признаци и симптоми на промяна в менталния статус, ще е необходима нервообразна диагностика (като компютърна томография или магнитен резонанс). Лечението се фокусира към понижение нивата на амоняк и реверсиране на метаболитната ацидоза. В допълнение, изисква се мониториране на амилаза и липаза, тъй като може да се получи панкреатит по време на остра ацидозна криза. Трябва да се мониторира внимателно сърдечния статус на пациента.
В случай, че се подозира PA, пациентът трябва да бъде преместен в лечебно заведение с подходящ персонал. Това включва генетици, невролози (особено, ако пациентът е с удар, припадъци или енцефалопатия), диетолози по метаболизма, нефролози или нефрологични медицински сестри (при нужда от диализа).
В дългосрочен план, пациентите с PA се лекуват с ниско протеинна диета, често суплементирана със специална лечебна храна, несъдържаща аминокиселините, посочени по-рано (валин, изолевцин, треонин и метионин). Добавянето на левокарнитин е необходимо за преодоляване на вторичния дефицит на карнитин и за сепариране и отстраняване на пропионовата киселина и метаболитите. Продължителната или интермитентна употреба на орални антибиотици за контролиране на чревните бактерии, произвеждащи пропионова киселина, е полезна при пациенти с MMA и PA. При някои пациенти може да има нужда от хронични ентерални лекарства като натрий или калиев цитрат, или сода бикарбонат за поддържане на подходящи бикарбонатни нива.
Детето е лекувано с ниско протеинна диета (изчислена от диетолог по метаболизма, въз основа на теглото, възрастта и състоянието – в този случай естествен протеин 1.5 g/kg/d и около 0.3 до 0.5 g/kg/d лечебна храна), L-карнитин (150 mg/kg/d) и биотин (1 mg/kg/d). След 6 седмици кръвната му картина, електролитите, амоняка и глюкозата са в норма. Обаче, за възрастта си – 8 месеца, се открива че има промяна в менталния статус и ниво на амоняк 595 μmol/L.
Въпрос
От какво лечение се нуждае малкият пациент по това време в допълнение към 10% декстроза с електролити, прилагана интравенозно (при 8- до 10-mg/kg/min скорост на инфузия на глюкоза)?
- Диализа
- Натриев фенилбутират
- Повече хранене
- Доласетрон
Верен отговор: Диализа
Диализата е показана за пациента, поради хиперамониемията и промяната в менталния статус.
Диализа
Диализата е показана по спешност при пациенти в кома и/или при ниво на амоняка по-високо от 500 μmol/L (>700 mcg/dL). Други индикации за диализа включват повишени амонячни нива независимо от адаптираните калории и лечебно хранене, наложителна корекция на ацидозата, лош клиничен статус, опасност от метаболитен синдром със сигнификантен електролитен дисбаланс.
Други показания за диализа включват повишаване нивото на амоняка, въпреки адекватното управление на калориите и хранителните вещества, корекция на ацидоза, лошо клинично състояние, загриженост за метаболитен удар и значителни електролитни дисбаланси.
Важно е да се разгледат всички обстоятелства при избора на метод на диализа. В конкретния случай, тъй като детето е кърмаче, трябва да се помисли за продължителна венозна хемофилтрация (CVVHF). CVVHF дава като резултат отлично очистване от амоняк и обикновено се понася добре от кърмачета. При хемодиализа има най-високата екстракция на амоняк, но употребата й при кърмачета може да доведе до сериозни усложнения.
Детето е стабилизирано и е готово за изписване от болница. Родителите му искат за знаят какво да очакват в бъдеще и как да се подготвят за обгрижването му.
Въпрос
Кое е вярно и е най-важно да се включи в препоръките на лекаря към родителите?
- Придържането към ниско протеинова диета е съществена част от дългосрочното лечение на детето
- Суплементирането с карнитин е ключово за добра прогноза
- Стриктното придържане към суплементирането с биотин е ключово за добра прогноза
- Прогнозата за детето е добра, тъй като то е било на 3 месеца при настъпване на РА
Верен отговор: Придържането към ниско протеинова диета е съществена част от дългосрочното лечение на детето
При даване на съвети на родители на кърмаче с PA трябва да се наблегне на придържането към ниско протеинова диета. Въпреки че PCC е ензим, отговарящ на биотин и биотина е включен в ранното лечение, отговор настъпва при много малко пациенти.
Съвети
Придържането към препоръчаната нискодозова протеинова диета е решаващ компонент при лечение на PA. Мониторирането на придържането към препоръките за диета е важно при балансиране на нуждата на пациента от протеин за поддържане на подходящ растеж и развитие към нуждата от ограничаване приема на протеин за лечение на PA. Неправилното съотношение протеин-енергия може да има много нежелани ефекти за здравето на пациента.
При реални ситуации, перфектното придържане към препоръките за диета не е винаги възможно. Дори и силно мотивирани родители могат да правят приспособявания на диетата на детето им с PA, поради причини като болест и обществени събития. Важно е екипът, участващ в лечението, да създаде подкрепяща връзка с тези, които се грижат за детето, за да им помогне да посрещнат неговите хранителни нужди.
Когато се дават съвети на родителите на това дете, относно прогнозата му, трябва да се отбележи, че ранната интервенция е жизненоважна, за да се помогне на децата с PA да достигнат своя потенциал. Полезните интервенции биха могли да включват специално коригиращо обучение и други социални и професионални услуги.
Пациенти, които са диагностицирани с PA преди раждане (от фамилната анамнеза или анамнезата на братя или сестри), или скоро след раждане, имат най-добрата прогноза, вероятно защото избягват декомпенсации. Началото на болестта през първата седмица от живота се характеризира с интелектуална неспособност и ранна смърт, със среден период на преживяемост от около 3 години. Късното начало на болестта (след 6 седмици живот) се характеризира с по-тежки двигателни нарушения и дистонии. Пациенти, при които болестта настъпва късно, имат обикновено перманентно неврологично увреждане.
В данни от анализ на 55 живи пациенти с PA, 75.5% от кохортата са имали интелектуална неспособност, а средният IQ е бил 55. Допълнителните усложнения включват хематологични абнормалности, сърдени заболявания, проблеми с храненето и нарушен растеж. Повечето от пациентите оценяват качеството си на живот като високо, но информация от гледна точка на родителите показва, че поведенческите проблеми са били 4 пъти по-чести при пациенти с PA, отколкото при здрави контроли.
При проучване с 80 пациенти с класически органични ацидурии, PA е била свързвана с най-лошата неврологична прогноза: 37% от пациентите са имали абнормални неврологични находки, 61% са имали абнормални психометрични резултати, а 56% са били с лезии на базалните ганглии.
Работата на лекаря е чрез лекарства, диети, навременно лечение на заболяването и обучителни програми, вкл. ранна интервенция, да максимализира неговия потенциал.
Заключение
Доставчиците на здравни грижи могат да не знаят за редки вродени грешки на метаболизма, но на всеки педиатричен пациент с метаболитна ацидоза, хиперамониемия и кетонурия трябва да се направи допълнително изследване за PA (и MMA). В дадения случай, детето е с метаболитна ацидоза, но няма сепсис, диабетна кетоциадоза или бъбречна тубулна ацидоза. Имало е също хиперамониемия с минимално доказателство за чернодробна дисфункция. Комбинацията от ацидоза и хиперамониемия трябва да наведе на мисълта за дефекти в урейния цикъл и ензимите, важни за метаболизма на продуктите на цикъла. Ниско протеинната диета доставя по-малко аминокиселини (следователно по-малко азот) и субстрати, които движат цикъла и произвеждат токсични бипробукти при пациенти без нормални нива на необходимите ензими.