Брой 8/2020
Д-р Н. Недева, Д-р Р. Робева
УСБАЛЕ ”Акад. Ив. Пенчев”, КЕ, МФ, МУ – София
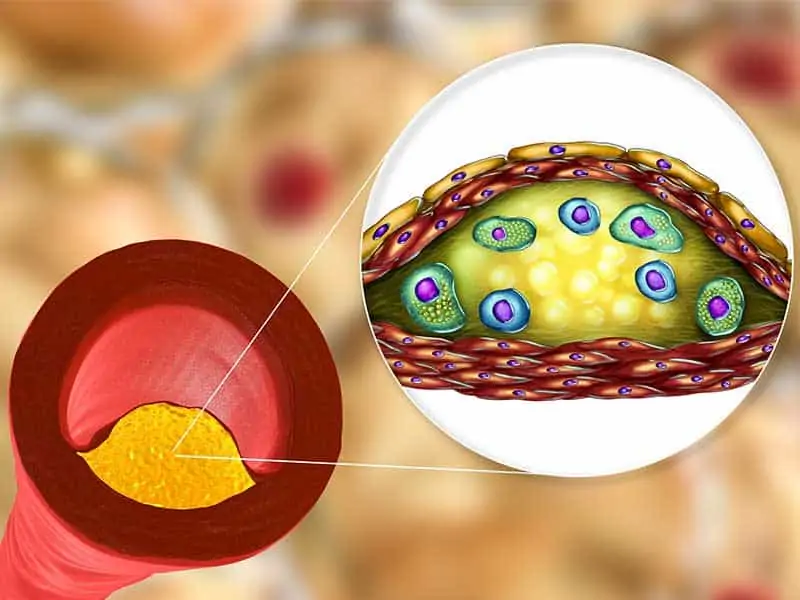
Дислипидемиите са основен рисков фактор за развитие на атеросклеротичната сърдечно-съдова болест, като в светлината на актуалните препоръки на ESC/EAS от 2019 година е необходима комплексна оценка на риска, лабораторните изследвания и етиологичните фактори. На тази база следва да се изгради терапевтична стратегия, с цел понижаване на нивата на LDL-холестерола до възможно най-ниски стойности. Особено агресивно трябва да е лечението на пациентите с много висок и висок сърдечно-съдов риск, както и при фамилни форми на хиперхолестеролемия, с оглед предотвратяване на големи сърдечно-съдови събития с фатален или нефатален изход. При оценката на пациентите винаги трябва да се отчита и възможността за вторична дислипидемия, което също може да повлияе терапевтичния подход.
Сърдечно-съдовите заболявания (ССЗ) са водеща причина за заболеваемост, смъртност и инвалидност в света. Атеросклеротичната сърдечно-съдова болест (АССБ) включва коронарната съдова болест (КСБ), мозъчния инфаркт и периферната съдова болест. Приблизително една трета от всички смъртни случаи в световен мащаб се дължат на ССЗ. От сърдечно-съдови заболявания умират над 4 милиона души в Европа всяка година. Смъртността е по-висока при жените, отколкото при мъжете, въпреки че смъртността от ССЗ при хора под 65-годишна възраст е по-честа при мъжете. Дислипидемията, тютюнопушенето и хипертонията са водещите рискови фактори за ССЗ при над 75% от случаите. Честотата на КСБ и на мозъчния инфаркт нараства в световен мащаб. За понижаване смъртността от ССЗ от решаващо значение са агресивния и комплексен контрол на основните рискови фактори като дислипидемия, хипертония, захарен диабет и тютюнопушене (1, 2).
От девет независими рискови фактори за развитие на миокарден инфаркт (МИ), дислипидемията е свързана с най-висок риск. Диагностиката и лечението на дислипидемията са ключов фактор за намаляване честотата и смъртността от КСБ и мозъчен инфаркт (3).
Много от пациентите преживяват първото сърдечно-съдово (СС) събитие и продължават да са изложени на висок риск от рецидиви. Повече от половината от намалението на СС смъртност през последните десетилетия се отдава на контролирането на СС рискови фактори и преди всичко на намаляване нивата на холестерола и артериалното налягане, както и контрол на тютюнопушенето. Икономически най-ефективни са лечението на дислипидемията със статини и подобрения контрол на АН. Тази благоприятна тенденция се неутрализира частично от ръста на другите рискови фактори като затлъстяване, ЗД тип 2 и застаряването на населението (4,5).
• Оценка на риска
Сърдечно-съдовият риск, в контекста на последните препоръки, означава вероятността дадено лице да развие фатално или нефатално атеросклеротично СС събитие за определен период от време. Съществуват много системи за оценка на риска, които са проучени изчерпателно, но повечето препоръки използват системата за (количествена) оценка на риска SCORE. Едно от предимствата на SCORE е, че тя може да бъде адаптирана за употреба при различни популации. Повечето системи за оценка на риска и всички клинични изпитвания се базират на общия холестерол (TC) и LDL- холестерола (LDL-C). SCORE изчислява 10-годишния кумулативен риск от първи фатален атеросклеротичен инцидент като миокарден инфаркт, инсулт или друга оклузивна артериална болест, включително внезапна сърдечна смърт (6). Основните принципи за оценка на риска в последните препоръки се свеждат до следното:
Лица, при които автоматично се приема много висок или висок общ СС риск. При тях не са необходими модели за изчисляване на риска, тъй като всички те имат нужда от активни мерки по отношение на всички рискови фактори (7, 8):
• При документирано сърдечно-съдово събитие;
• Лица със захарен диабет (ЗД) тип 2 и увреждане на таргетни органи или такива с над 3 основни рискови фактора;
• Лица със ЗД тип 1 с ранно начало и над 20-годишна давност;
• Много високи нива на отделните рискови фактори;
• Хронично бъбречно заболяване (CKD) с eGFR <30ml/min/1,73m2;
• Пациенти с фамилна хиперхолестролемия (FH);
При всички останали лица се препоръчва приложение на система за рискова оценка като SCORE, която да изчисли общия сърдечно-съдов риск. Преведена на български език таблица SCORE може да бъде намерена на сайта на Дружеството на кардиолозите в България – https://bgcardio.org/ (https://bgcardio.org/storage/app/media/uploaded-files/2016_%20Management_of_Dyslipidaemias.pdf);
• Скрининг за дислипидемии трябва да се има предвид при всички мъже на възраст ≥40 години и при жени на възраст ≥50 години или след менопауза, особено при наличие на други рискови фактори;
• На скрининг за дислипидемии трябва да бъдат подложени и пациенти с възможни фамилни форми на нарушения в липопротеините, по-специално тези с фамилна хиперхолестеролемия (FH), която е най-честото моногенно нарушение, свързано с преждевременно ССЗ. Клиничните прояви на тези заболявания – ксантоми, ксантелазми и ранен аркус корнеалис (<45-годишна възраст) трябва да бъдат търсени активно, тъй като те са признак за наличие на тежко нарушение в липидния профил, • Антиретровирусните терапии също могат да допринесат за ускорена атеросклероза; • Скрининг за дислипидемии е показан при пациенти с периферна артериална болест (ПАБ) или при наличие на повишена дебелина на каротидната интима– медиа или каротидни плаки. • Насочено търсене на дислипидемии е уместно при децата на пациенти с тежка дислипидемия, както при членовете на семейства на пациенти с преждевременно ССЗ. Системата SCORE може да надцени риска при възрастни пациенти над 65 години, затова преди започване на лечение при тях е необходима задълбочена клинична преценка. Тези болни подлежат на стриктен контрол по отношение на съпътстващата хипертония и други рискови фактори, както и на спиране на тютюнопушенето. Дислипидемията следва да се контролира като се избягват нежеланите лекарствени ефекти от свръхмедикация. Новото при оценка на риска е, че HDL-холестеролът вече не се счита за силно протективен фактор. Установено е, че много високите стойности на HDL-холестерола > 2,3 ммол/л са свързани с повишена честота на атеросклеротични ССЗ.
• Лабораторни изследвания
Препоръките за клиничната практика са лабораторни изследвания на (6):
• общ холестерол (TC), който трябва да се използва за оценка на общия риск от ССЗ чрез системата SCORE (https://bgcardio.org/storage/app/media/uploaded-files/2016_%20Management_of_Dyslipidaemias.pdf);
• LDL-холестерол, който се препоръчва като основен метод за анализ на липиди за скрининг, диагностика и проследяване на състоянието;
• HDL-холестерол, който се препоръчва за по-нататъшно прецизиране при оценката на риска, чрез онлайн SCORE (https://bgcardio.org/storage/app/media/uploaded-files/2016_%20Management_of_Dyslipidaemias.pdf) системата;
• Триглицериди (TG), измерването им се препоръчва като част от рутинния процес на липиден анализ;
• Не-HDL-C оценка се препоръчва за оценка на риска, особено при хора с високи нива на TG, ЗД, затлъстяване или много ниски нива на LDL-C.
• Анализът на ApoB се препоръчва за оценка на риска, особено при хора с високи нива на TG, ЗД, затлъстяване, метаболитен синдром или много ниски нива на LDL-C. Той може да бъде използван като алтернатива на LDL-C, ако е наличен, като основно измерване за скрининг, диагностика и контрол и се предпочита пред не-HDL-C при хора с високи нива на TG, ЗД, затлъстяване или много ниски нива на LDL-C;
• Измерването на Lp(a) трябва да се вземе предвид поне веднъж през живота на всеки възрастен човек, за да се идентифицират тези с много високи стойности /наследствени нива на Lp (a) >430 nmol/L/, които могат да имат висок риск от смърт, поради атеросклеротично ССЗ, еквивалентен на свързания с риска при хетерозиготна фамилна хиперхолестеролемия. Lp (a) трябва да се изследва и проследи при избрани пациенти с фамилна анамнеза за преждевременно ССЗ и за прекласификация при хора, които са на границата между умерен и висок риск.
Основната клинична цел според последните препоръки на EAS/ESC от 2019 г е намаляване на атеросклеротичния риск за ССЗ при възрастни, основно чрез редуциране на LDL-холестерола. Важността на това понижаване се подчертава от проведените мета-анализи, които показват дозозависимо намаляване на риска от развитие на атеросклеротично събитие. Колкото по-голямо е абсолютното намаление на LDL- холестерола, толкова по-голямо е намалението на риска от СС събитие. Относителното намаляване на риска от неблагоприятни сърдечно-съдови събития е пропорционално на абсолютното понижение на LDL- C (8). Затова се конкретизират следните препоръки:
• При пациенти с много висок сърдечно-съдов риск, независимо дали при вторична профилактика, или (рядко) при първична профилактика, се препоръчват нива на LDL-C <1.4 mmol/L или намаляване с > 50% от изходната стойност на LDL-C;
• За пациенти с атеросклеротично ССЗ, които преживеят второ съдово събитие в рамките на 2 години (може и различно от първото събитие), на фона на максимално толерирана терапия със статини, се препоръчва ниво на LDL-C <1,0 mmol / L;
• При пациенти с висок сърдечно-съдов риск се препоръчва намаление на LDL-C <1.8 mmol/L или на LDL-C > 50% от изходната стойност;
• При пациенти с умерен сърдечно-съдов риск, цел е постигане на нива на LDL-C< 2,6 mmol/L;
• При индивиди с нисък сърдечно-съдов риск може да се обмисли цел за LDL-C<3.0 mmol;
• Наследствени и вторични дислипидемии
При оценката на дислипидемиите и съответно на риска от АССБ следва да се има предвид, че в почти 50% от случаите промените в нивата на липопротеините са генетично обусловени, като до момента са установени над 100 гена, които може пряко да повлияят липидните нива (9). Липидните нарушения може да включват повишени нива на холестерола (хиперхолестеролемия, Клас IIa по класификацията на Fredrickson), триглицеридите (хипертриглицеридемия, Класове I, IV и V по класификацията на Fredrickson), или комбинация от двете (смесена дислипидемия, Класове III или IIb по класификацията на Fredrickson) (10). Дислипидемиите може да бъдат резултат от моногенни мутации, както и от комплексни полигенни влияния, като особено важно място по отношение на сърдечно-съдовия риск заема фамилната хиперхолестеролемия (ФХ) (10,11). Фамилната хиперхолестеролемия с автозомно-доминантно унаследяване се характеризира с високи нива на LDL-C през целия живот на пациента и съответно 10-20 пъти по-висок риск от развитие на КСБ в сравнение със здравата популация (10).
Развитието на хиперхолестеролемия се дължи на вариации в гените, свързани с рецептор-медиираното поглъщане на LDL-С в хепатоцитите. До момента са установени три основни гена, отговорни за заболяването, които кодират рецептора за LDL, аполипопротеин В и пропротеин конвертаза субтилизин/кексин тип 9 (PCSK9) (10,11). Изключително рядко мутациите може да се срещнат в хомозиготно състояние (хомозиготна ФХ), с тежка клинична картина. Наблюдават се обширни ксантоми, изразена преждевременна и прогресираща АССБ при нива на общия холестерол над 13 mmol/L. Повечето пациенти развиват КСБ и аортна стеноза преди 20-годишна възраст и умират преди навършване на 30 години. Ранната идентификация на тези деца и своевременното им насочване към съответните специалисти имат решаващо значение за предотвратяване на ранната смъртност (8).
Пациентите трябва да бъдат лекувани агресивно с медикаменти, понижаващи LDL-С и LDL-C афереза. Това лечение (на всеки 1-2 седмици) може да намали плазмените нива на LDL-C с 55-70%. Лечението на деца с хомозиготна ФХ включва здравословен начин на живот и лечение със статини. Препоръчва се антилипемична терапия да се обмисли на възраст между 6-10 години и в най-ниската ефективна доза. Прицелните стойности на LDL- C e <3,5mmol/l (6, 8).
За разлика от хомозиготната хиперхолестеролемия, хетерозиготната автозомно-доминантна хиперхолестеролемия е много по-често срещана. Тя е съществен рисков фактори за поява на преждевременна АССБ, поради трайно повишените плазмени нива на LDL-C, но често остава недиагностицирана. Ако бъдат оставени без лечение, мъжете и жените с хетерозиготна ФХ развиват КСБ преди 55 и съответно 60-годишна възраст. При ранно диагностициране и правилно лечение, рискът от АССБ може да бъде намален драстично, така че да се постигне продължителност на живота при пациентите, сравнима с тази в общата популация. В около 95% от случаите на ФХ причина за заболяването е мутация в гена за LDL рецептора. Въпреки това, диагностиката се базира обикновено върху фамилната анамнеза, клиничната картина и лабораторните показатели при болните, докато възможности за генетични изследвания са налични рядко у нас (8, 12). Понастоящем са налични три диагностични скали за фамилна хиперхолестеролемия (10, 13, 14, 15):
• US MedPed Program –диагностични критерии, които отчитат нивата на общия холестерол спрямо възрастта и анамнезата;
• Критерии на Simon Broome Register Group – критерии, включващи клинични характеристики, нива на холестерола и молекулна диагноза;
• Dutch Lipid Clinic Network (DLCN) критерии – базирани върху клинични симптоми, лабораторни показатели, фамилна анамнеза, като може да включват и генетични изследвания, които обаче не са задължителни. Тези критерии се използват широко и у нас(10, 15).
Критерии група 1: фамилна анамнеза
Точки
(i) Първостепенен родственик с известна преждевременна исхемична болест на сърцето (<55 години за мъже; <60 години за жени) ИЛИ (ii) Първостепенен родственик с LDL-холестерол >95-ти персентил спрямо възраст и пол за съответната държава
1
(iii) Първостепенен родственик със сухожилни ксантоми и/или аркус корнеалис
ИЛИ
(iv) Деца <18 години с LDL-холестерол >95-ти персентил спрямо възраст и пол за съответната държава
2
Критерии група 2: клинични данни
(i) преждевременна исхемична болест на сърцето (<55 години за мъже; <60 години за жени)
2
(i) преждевременна мозъчно-съдова болест или периферно-съдова болест (<55 години за мъже; <60 години за жени)
1
Критерии група 3: физикално изследване
(i) Сухожилни ксантоми
6
(ii) Аркус корнеалис <45 години 4 Критерии група 4: лабораторни данни (LDL-холестерол) >8.5 mmol/L
8
6.5–8.4 mmol/L
5
5.0–6.4 mmol/L
3
4.0–4.9 mmol/L
1
Критерии група 5: молекулярни генетични изследвани (ДНК анализ)
(i) Мутации в гените за LDLR, APOB, или PCSK9
8
Ясно е, че при хетерозиготна форма на фамилна хиперхолестеролемия също е необходимо бързо понижаване на липидните нива. Трябва да се започне високо-интензивно статиново лечение, в повечето случаи, комбинирано с езетимиб. При пациенти с ФХ и много висок риск от АССБ целите на терапията са постигане намаление на LDL-C с над 50% от изходното и прицелни нива на LDL-C <1.4 mmol/L. В отсъствието на съпътстваща АССБ или други основни рискови фактори, пациентите с ФХ следва да постигат намаление на нивото на LDL-C с над 50% и прицелни стойности за LDL-C <1,8 mmol/L. PCSK9 инхибиторите са относително нов клас медикаменти, които понижават нивата на LDL-C с до 60% над постигнатото при терапия със статини. PCSK9 инхибиторите трябва да се имат предвид и при пациенти с хетерозиготна ФХ, които не понасят статини, както и при тези с високи стойности на Lp(a) (6, 8).
Освен фамилната хиперхолестеролемия, друга често срещана форма на наследствена дислипидемия е фамилната комбинирана хиперлипидемия (ФКХ), характеризираща се с повишени нива на LDL-C, триглицериди, а често и двете. Фамилната комбинирана хиперлипидемия се среща при 1.0% – 2.0% от общата популация и при 10% – 20% от прекаралите миокарден инфаркт (16). ФКХ е комплексна болест, с полигенно унаследяване, като фенотипът може да варира значително в рамките на една фамилия. Поради голямата между- и интраиндивидуална вариабилност по отношение на липидните стойности, диагнозата често се пропуска в клиничната практика. ФКХ се характеризира с липиден профил, който често наподобява този при метаболитен синдром и ЗД, с оглед ниските нива на HDL-C и високите триглицериди, но са налице и значителни разлики. Apo B е повишен при ФКХ, но не и при метаболитен синдром. Нивата на LDL-C са по-високи при ФКХ, отколкото при МС.
Същевременно промените в стила на живот по-трудно повлияват дислипидемията при ФКХ в сравнение с тази при пациентите с метаболитен синдром (17, 18). Независимо от различията и при ФКХ, и при метаболитен синдром е необходима интензивна липидо-понижаваща терапия, с цел минимизиране на сърдечно-съдовия риск (18). Хипертриглицеридемията често се среща в отделни семейства като самостоятелно нарушение, или заедно с други липидни отклонения. Понастоящем е известно, че в повечето случаи хипертриглицеридемията е резултат от полигенно въздействие, обусловено от няколко генетични полиморфизма, в съчетание с фактори на околната среда. Тежките нарушения в катаболизма на хиломикроните и VLDL водят до хиломикронемия и TG нива >11.2 mmol/L (1000 mg/dL), като в тези случаи може да се наблюдава мътен и млекоподобен серум. Рискът от панкреатит е клинично значим, ако TG надхвърлят 10 mmol/L, като често панкреатитът рецидивира. Хипертриглицеридемията е причина за около 10% от всички случаи на панкреатит, поради което действията, насочени към превенция на това усложнение, са от голямо значение. Всеки фактор, който повишава производството на VLDL, може да увеличи риска от панкреатит, а консумацията на алкохол е най-честият допринасящ фактор. Хроничната изразена хиломикронемия може да доведе също така до развитие на еруптивни ксантоми, хепатоспленомегалия и липемия ретиналис, като се свързва и с повишен сърдечно-съдов риск. Рестрикцията на приеманите мазнини и въздържанието от употреба на алкохол са ключови за редукцията на повишените триглицериди, наред с медикаментозната терапия. При пациенти с диабет е от голямо значение и оптимизацията на гликемичния контрол. В остри условия бързо понижение на TG нива може да се постигне с плазмафереза (6, 8, 19).
В клиничната практика следва да се има предвид голямата честота на вторични дислипидемии. Влиянието на допълнителните фактори е особено изразено при пациенти с генетична предиспозиция за липидни нарушения. Най-често вторична хипертриглицеридемия се наблюдава при неразпознат или нелекуван захарен диабет. Други заболявания, които може да доведат до вторична хипертриглицеридемия, са нефрозният синдром, острият хепатит, хроничната бъбречна недостатъчност, лупусът, автоимунната хиломикронемия, наличието на липодистрофия или редки нарушения в натрупването на гликоген и др. Редица хормонални препарати (кортикостероиди, естрогени), както и някои нехормонални медикаменти, също може да доведат до увеличаване нивата на триглицеридите (19, 20). Увеличени нива на холестерола, с или без повишени триглицериди, може да се наблюдават при нефрозен синдром, хипотиреоидизъм, дефицит на растежен хормон, обструкция на жлъчните пътища, нервна анорексия, както и при употреба на някои медикаменти (20). Според голямо проучване в клиника по липидология, 28% от пациентите с абнормен липиден профил са били с вторична дислипидемия, което подчертава необходимостта от подробни допълнителни изследвания при болни със суспектни клинична признаци (21).
Оценката на състоянието при пациент с вероятна дислипидемия изисква на първо място да се уточни вида на нарушението, като се определят нивата на LDL-C, триглицеридите, не-HDL-C, Lp(a) и HDL-C. Често при пациентите може да се наблюдава смесена дислипидемия. Особено важно е да се изключат /или лекуват/ вторичните причини за промени в липидния профил. В този аспект е необходима адекватна оценка на диетичния режим, вредните навици, придружаващите заболявания и съпътстващата медикация при пациентите. Вторична причина за дислипидемия следва да се подозира при рязко влошаване на липидните показатели у пациенти с леки или липсващи до момента отклонения в липидния профил. Следваща стъпка е събирането на подробна фамилна анамнеза и оценка в насока генетично обусловена дислипидемия, особено при по-млади пациенти, чиито родственици са страдали от преждевременно появили се сърдечно-съдови заболявания или панкреатит. В някои случаи е необходимо извършване и на по-сложни лабораторни /включително генетични/ изследвания извън стандартно изследвания липиден панел. Tъй като лечението на дислипидемията цели преди всичко предотвратяване на сърдечно-съдовите усложнения, оценката на сърдечно-съдовия риск е ключова за преценка необходимостта от липидо-понижаваща терапия, включително нейния вид и интензивност (22).
В заключение, дислипидемията е комплексен проблем, който може да възникне в резултат на различни генетични причини или фактори на околната среда. Независимо от етиологията обаче, ранното и интензивно лечение на липидните отклонения е единственият механизъм, чрез който може да бъдат предотвратени ранната сърдечно-съдова заболеваемост и смъртност.
Библиография:
1. World Health Organization. Regional Office for Europe. (2011). Global atlas on cardiovascular disease prevention and control: published by the World Health Organization in collaboration with the World Heart Federation and the World Stroke Organization. World Health Organization. Regional Office for Europe.
2. Townsend N, Nichols M, Scarborough P, Rayner M. Cardiovascular disease in Europe–epidemiological update 2015. Eur Heart J 2015; 36:2696–705.
3. Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, McQueen M, Budaj A, Pais P, Varigos J, Lisheng L: Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): casecontrol study. Lancet 2004, 364:937-52.
4. Bjorck L, Rosengren A, Bennett K, Lappas G, Capewell S. Modelling the decreasingcoronary heart disease mortality in Sweden between 1986 and2002. Eur Heart J 2009; 30:1046–1056.
5. Aspelund T, Gudnason V, Magnusdottir BT, Andersen K, Sigurdsson G, ThorssonB, Steingrimsdottir L, Critchley J, Bennett K, O’Flaherty M, Capewell S.Analysing the large decline in coronary heart disease mortality in the Icelandicpopulation aged 25–74 between the years 1981 and 2006. PLoS One2010;5:e13957.
6. Catapano A et al. European GuidelinesESC/EAS 2016 Managementof dyslipidemias. European Heart Journal (2016) 37, 2999–3058.
7. Cooney MT, Dudina A, Whincup P, Capewell S, Menotti A, Jousilahti P, NjolstadI, Oganov R, Thomsen T, Tverdal A, Wedel H, Wilhelmsen L, Graham I. Reevaluatingthe Rose approach: comparative benefits of the population and highriskpreventive strategies. Eur J Cardiovasc PrevRehabil 2009;16:541–549.
8. Mach F, Baigent C et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS) European Heart Journal 2020; 41, 111188
9. García-Giustiniani D, Stein R. Genetics of Dyslipidemia. Arq Bras Cardiol. 2016;106(5):434-438.
10. Patni N, Ahmad Z, Wilson DP. Genetics and Dyslipidemia. [Updated 2020 Feb 11]. In: Feingold KR, Anawalt B, Boyce A, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-. https://www.ncbi.nlm.nih.gov/books/NBK395584/
11. Rader DJ, Cohen J, Hobbs HH. Monogenic hypercholesterolemia: new insights in pathogenesis and treatment. J Clin Invest. 2003;111(12):1795-1803.
12. Nordestgaard BG, Chapman MJ, Humphries SE, et al.; European Atherosclerosis Society Consensus Panel. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society. Eur Heart J 2013;34:3478-3490a.
13. Williams RR, Hunt SC, Schumacher MC, Hegele RA, Leppert MF, Ludwig EH, Hopkins PN. Diagnosing heterozygous familial hypercholesterolemia using new practical criteria validated by molecular genetics. Am J Cardiol. 1993;72:171–176.
14. Lobo RA. Clinical review 27: Effects of hormonal replacement on lipids and lipoproteins in postmenopausal women. J Clin Endocrinol Metab. 1991;73:925–930.
15. World Health Organization. Familial hypercholesterolemia—report of a second WHO Consultation. Geneva SWHO, 1999.
16. Veerkamp MJ, de Graaf J, Bredie SJ, Hendriks JC, Demacker PN, Stalenhoef AF. Diagnosis of familial combined hyperlipidemia based on lipid phenotype expression in 32 families: results of a 5-year follow-up study. Arterioscler Thromb Vasc Biol 2002;22:274-282.
17. Gaddi AV, Cicero AFG. Bologna. Italy: Esculapio Ed; 2006. Metabolic syndromes: diagnosis, prognosis, therapy; 145–52.
18. Gaddi A, Cicero AF, Odoo FO, Poli AA, Paoletti R; Atherosclerosis and Metabolic Diseases Study Group. Practical guidelines for familial combined hyperlipidemia diagnosis: an up-date. Vasc Health Risk Manag. 2007; 3(6):877-886.
19. Chait A, Subramanian S. Hypertriglyceridemia: Pathophysiology, Role of Genetics, Consequences, and Treatment. [Updated 2019 Apr 23]. In: Feingold KR, Anawalt B, Boyce A, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-. https://www.ncbi.nlm.nih.gov/books/NBK326743/
20. Benuck I, Wilson DP, McNeal C. Secondary Hypertriglyceridemia. [Updated 2020 Jun 1]. In: Feingold KR, Anawalt B, Boyce A, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-. https://www.ncbi.nlm.nih.gov/books/NBK395574/
21. Vodnala D, Rubenfire M, Brook RD. Secondary causes of dyslipidemia. Am J Cardiol. 2012;110(6):823-825.
22. Feingold KR. Approach to the Patient with Dyslipidemia. [Updated 2020 May 11]. In: Feingold KR, Anawalt B, Boyce A, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-. https://www.ncbi.nlm.nih.gov/books/NBK326736/




